Pila alcalina para niños
Datos para niños Pila alcalina |
||
|---|---|---|
 Pilas alcalinas
|
||
| Ánodo | Zinc pulverizado | |
| Cátodo | Dióxido de manganeso (MnO2) | |
| Electrolito | Alcalino: hidróxido de potasio (KOH) | |
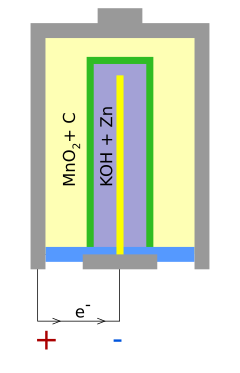
Las pilas alcalinas son un tipo de pilas eléctricas que producen energía gracias a una reacción química. En estas pilas, el zinc actúa como polo negativo (llamado ánodo) y el dióxido de manganeso (MnO2) como polo positivo (llamado cátodo). Para que la reacción ocurra, usan una sustancia especial llamada hidróxido de potasio como electrolito.
Las pilas alcalinas son muy comunes y las usamos en muchos aparatos electrónicos. A diferencia de las pilas salinas (las de zinc-carbono), las alcalinas usan hidróxido de potasio en lugar de cloruro. Aunque ambas dan un voltaje similar (alrededor de 1,5 voltios), las pilas alcalinas duran mucho más y pueden almacenar más energía.
También existen las pilas de óxido de plata, que a veces compiten con las alcalinas, especialmente en tamaños pequeños como las pilas de botón. Las de óxido de plata duran más y tienen más energía, pero las alcalinas son más económicas.
Contenido
¿Cómo funcionan las pilas alcalinas?
Dentro de una pila alcalina, el polo negativo (ánodo) está hecho de zinc en polvo. Este polvo tiene una superficie muy grande, lo que ayuda a que la reacción química sea más rápida y se produzcan más electrones. El polo positivo (cátodo) está hecho de dióxido de manganeso.
La principal diferencia con las pilas de zinc-carbono es el electrolito. Las pilas alcalinas usan hidróxido de potasio (KOH), mientras que las de zinc-carbono usan cloruro de amonio o cloruro de zinc.
Reacciones químicas dentro de la pila
Cuando una pila alcalina está funcionando, ocurren dos reacciones principales:
- Oxidación (en el ánodo): El zinc se transforma y libera electrones.
* Zn (s) + 2OH− (aq) → ZnO (s) + H2O (l) + 2e−
- Reducción (en el cátodo): El dióxido de manganeso recibe esos electrones.
* 2MnO2 (s) + H2O (l) + 2e− → Mn2O3 (s) + 2OH− (aq)
Estas reacciones hacen que los electrones se muevan del ánodo al cátodo, creando la corriente eléctrica que alimenta nuestros dispositivos.
¿Qué pasa en el ánodo?
El zinc metálico (Zn) en el ánodo libera dos electrones. Dependiendo de la cantidad de hidróxido de potasio, el zinc puede formar diferentes compuestos, como el ion tetrahidroxizincato (II) o el óxido de zinc (ZnO).
¿Qué pasa en el cátodo?
El dióxido de manganeso (MnO2) en el cátodo recibe los electrones y se convierte en hidroxióxido de manganeso (III), MnO(OH).
Reacción general de la pila
La reacción química total que ocurre en una pila alcalina es: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): Zn + 2MnO_2 + H_2O \rightarrow ZnO + 2MnO(OH) Esta reacción consume agua, por eso se dice que las pilas alcalinas son "pilas secas".
Capacidad de las pilas alcalinas
Las pilas alcalinas tienen una mayor capacidad que las pilas de zinc-carbono del mismo tamaño. Esto significa que pueden funcionar por más tiempo, entre tres y cinco veces más. Esto se debe a que usan dióxido de manganeso más puro y denso, y tienen menos espacio ocupado por otros componentes.
La duración de una pila alcalina depende mucho del aparato al que esté conectada. Por ejemplo, una pila AA puede durar mucho en un control remoto (que usa poca energía), pero mucho menos en una cámara digital (que usa mucha energía). A medida que la pila se usa, su voltaje disminuye poco a poco.
Voltaje de las pilas alcalinas
El voltaje normal de una pila alcalina es de 1,5 V. Si conectas varias pilas en serie, puedes obtener voltajes más altos, como 3 V o 4,5 V. Cuando una pila alcalina está nueva y sin usar, su voltaje puede estar entre 1,50 y 1,65 V. Cuando se está usando, el voltaje promedio suele ser de 1,1 a 1,3 V. Una pila completamente agotada tendrá un voltaje de 0,8 a 1,0 V.
Las pilas alcalinas también funcionan bien en un rango de temperaturas más amplio, incluso a -30 °C.
Corriente eléctrica
La cantidad de corriente que una pila alcalina puede producir depende de su tamaño. Las pilas más grandes pueden entregar más corriente porque tienen una resistencia interna menor. Por ejemplo, una pila AA puede dar unos 700 mA sin calentarse mucho. Las pilas más grandes, como las de tipo C y D, pueden dar más corriente, lo que las hace ideales para aparatos que necesitan mucha energía, como linternas potentes o equipos de música portátiles.
Construcción de las pilas alcalinas
Las pilas alcalinas se fabrican en tamaños estándar, como las pilas cilíndricas (AAA, AA, C, D) y las pilas de botón. Varias pilas individuales pueden unirse para formar una "batería", como las de 4,5 V o las de 9 V.
Una pila cilíndrica tiene un exterior de acero que actúa como el polo positivo. Dentro, hay una pasta de dióxido de manganeso y polvo de carbono. En el centro, hay un separador que evita que los materiales del polo positivo y negativo se mezclen, previniendo cortocircuitos. Este separador permite el paso de los iones.
El polo negativo está hecho de polvo de zinc mezclado con un gel que contiene el electrolito de hidróxido de potasio.

En las pilas estándar (AAA, AA, C, D), el polo negativo (-) es la parte plana de abajo, y el polo positivo (+) es el botón metálico elevado de arriba.
Recarga de pilas alcalinas
Algunas pilas alcalinas están diseñadas para ser recargadas, pero la mayoría no lo están. Intentar recargar una pila que no es recargable puede ser peligroso. Podría romperse o liberar líquidos que pueden dañar tus aparatos.
Fugas en las pilas alcalinas
Con el tiempo, las pilas alcalinas pueden tener fugas de hidróxido de potasio. Esta sustancia es corrosiva y puede irritar la piel, los ojos y las vías respiratorias. Para evitar esto, no intentes recargar pilas desechables, no mezcles diferentes tipos de pilas en un mismo aparato, cambia todas las pilas a la vez, guárdalas en un lugar seco y deséchalas correctamente cuando se agoten.
Si una pila tiene una fuga, el hidróxido de potasio puede formar cristales que se extienden y dañan los circuitos de los aparatos o incluso los muebles.
Eliminación de pilas alcalinas
Cuando las pilas alcalinas se crearon en los años 60, contenían un poco de mercurio. Con el tiempo, los fabricantes han logrado reducir mucho la cantidad de mercurio. Hoy en día, la mayoría de las pilas alcalinas no tienen mercurio añadido.
Es muy importante desechar las pilas correctamente. No deben tirarse a la basura común porque pueden ser perjudiciales para el medio ambiente. En muchos lugares, existen puntos de recogida especiales o estaciones de reciclaje donde puedes llevar tus pilas usadas. En Europa, por ejemplo, hay leyes que obligan a los establecimientos que venden pilas a aceptar las pilas viejas para su reciclaje.
Al depositarlas en los sitios autorizados, ayudamos a proteger el medio ambiente.
Véase también
 En inglés: Alkaline battery Facts for Kids
En inglés: Alkaline battery Facts for Kids
- Batería (electricidad)
- Batería recargable
- Batería alcalina recargable
- Lewis Urry
- Pila de limón
- Reciclaje de baterías
- Tipos de pila