Peróxido de litio para niños
Datos para niños
Peróxido de litio |
||
|---|---|---|
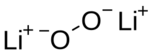 Estructura química
|
||
 __ Li+ __ O−
|
||
| General | ||
| Fórmula molecular | Li2O2 | |
| Identificadores | ||
| Número CAS | 12031-80-0 | |
| ChemSpider | 21489577 23787, 21489577 | |
| PubChem | 25489 | |
| UNII | 9ANX556R5F | |
|
InChI
InChI=InChI=1S/2Li.O2/c;;1-2/q2*+1;-2
Key: HPGPEWYJWRWDTP-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Masa molar | 46,022 g/mol | |
El peróxido de litio es un compuesto químico inorgánico con la fórmula química Li2O2. Se ve como un polvo blanco y no absorbe la humedad del aire, lo que lo hace muy útil.
Este compuesto es conocido por su capacidad de ayudar a limpiar el aire. Por ejemplo, se ha usado en naves espaciales para eliminar el dióxido de carbono y producir oxígeno.
Contenido
¿Cómo se fabrica el peróxido de litio?
El peróxido de litio se crea a partir de una reacción química. Para obtenerlo, se mezclan dos sustancias: el peróxido de hidrógeno y el hidróxido de litio.
Proceso de creación
Al principio, la mezcla de peróxido de hidrógeno e hidróxido de litio forma una sustancia intermedia. Esta sustancia se llama hidroperóxido de litio.
Luego, se le quita el agua a este hidroperóxido de litio. Este proceso se llama deshidratación. Al final, se obtiene el peróxido de litio puro.
Descomposición del peróxido de litio
El peróxido de litio es estable, pero si se calienta mucho, se descompone. A una temperatura de unos 450 grados Celsius, se convierte en óxido de litio y libera oxígeno.
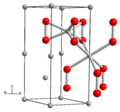
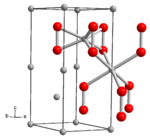
Los científicos han estudiado la estructura del peróxido de litio. Han usado una técnica llamada cristalografía de rayos X para entender cómo están organizados sus átomos.
¿Para qué se usa el peróxido de litio?
El peróxido de litio tiene usos muy importantes, especialmente en lugares donde el aire debe ser purificado.
Uno de sus usos más destacados es en los sistemas de purificación de aire. Se utiliza en naves espaciales y submarinos. Allí, ayuda a absorber el dióxido de carbono que los tripulantes exhalan.
Al mismo tiempo que absorbe el dióxido de carbono, el peróxido de litio libera oxígeno. Esto es vital para que los astronautas puedan respirar en el espacio. La reacción química que ocurre es: <chem>2Li2O2 + 2CO2</chem> → <chem>2Li2CO3 + O2 </chem>
Baterías de litio-aire
El peróxido de litio también es clave en el desarrollo de nuevas baterías. Es la base de un tipo de batería llamada batería de litio-aire.
Estas baterías son especiales porque usan el oxígeno del aire para funcionar. Esto significa que no necesitan llevar oxígeno almacenado dentro de ellas. Así, las baterías pueden ser más ligeras y pequeñas.
Galería de imágenes
Ver también
- Óxido de litio
- Peróxido
- Peróxido de sodio
Véase también
 En inglés: Lithium peroxide Facts for Kids
En inglés: Lithium peroxide Facts for Kids