Nucleófilo para niños
Un nucleófilo es una especie química que tiene electrones disponibles para compartir. Imagina que es como un "donante" de electrones. En química, los electrones son partículas muy pequeñas que tienen carga negativa y son clave para formar enlaces entre átomos.
Un nucleófilo "dona" un par de sus electrones a otra especie química, llamada electrófilo, que es como un "receptor" de electrones. Al compartir estos electrones, forman un nuevo enlace químico.
Los nucleófilos pueden ser partículas con carga negativa (llamadas aniones) o moléculas neutras que tienen un par de electrones "libres" (no usados en otros enlaces).
Algunos nucleófilos son "ambidentados", lo que significa que tienen dos lugares diferentes desde donde pueden donar sus electrones. Un ejemplo es el tiocianato (SCN-).
Contenido
¿Qué es la Nucleofilia?
La nucleofilia es una medida de cuán "fuerte" o "bueno" es un nucleófilo para donar sus electrones y formar un nuevo enlace. Es como medir qué tan rápido puede reaccionar.
Factores que Influyen en la Nucleofilia
Varios factores afectan la fuerza de un nucleófilo:
- La carga: Si un nucleófilo tiene una carga negativa, suele ser más fuerte. Por ejemplo, HO- es más nucleófilo que H2O.
- La basicidad: Los nucleófilos que son bases más fuertes (es decir, que tienen una mayor tendencia a aceptar protones) suelen ser también mejores nucleófilos. Por ejemplo, NH3 es mejor nucleófilo que H2O.
- La polarizabilidad: Esto se refiere a qué tan fácil es que la "nube" de electrones de un átomo se deforme. Los átomos más grandes tienen nubes de electrones más grandes y son más fáciles de deformar, lo que los hace mejores nucleófilos. Por ejemplo, I- es más nucleófilo que Cl-.
- El disolvente: El líquido en el que ocurre la reacción (el disolvente) también influye. Algunos disolventes pueden "rodear" y estabilizar al nucleófilo, haciendo que sea menos reactivo.
- El impedimento estérico: Si el nucleófilo es muy grande o tiene muchas "ramas" alrededor del átomo que dona los electrones, puede ser difícil para él acercarse al electrófilo. Esto se llama impedimento estérico y disminuye la nucleofilia. Por ejemplo, CH3O- es más nucleófilo que (CH3)3CO- porque este último es más voluminoso.
¿Cómo Reaccionan los Nucleófilos?
Los nucleófilos participan en varios tipos de reacciones químicas importantes.
Reacciones de Sustitución Nucleófila
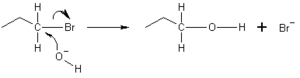
En estas reacciones, un nucleófilo reemplaza a otro átomo o grupo de átomos en una molécula. Es como si el nucleófilo llegara y "sustituyera" a alguien que ya estaba allí.
Reacciones de Adición Nucleófila
Aquí, el nucleófilo se "añade" a una parte de una molécula que tiene una doble o triple conexión (un grupo electrófilo). Es como si el nucleófilo se uniera a la molécula, haciéndola más grande.
Ejemplos de Nucleófilos Comunes
Los nucleófilos se encuentran en muchas sustancias químicas. Aquí tienes algunos ejemplos según el tipo de átomo que dona los electrones:
Nucleófilos con Carbono
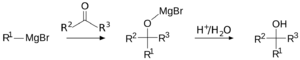
Estos son compuestos donde el carbono es el átomo que dona los electrones. Ejemplos incluyen los reactivos de Grignard y los alquil-litio, que son muy usados para construir moléculas más grandes. También los carbaniones, que son átomos de carbono con carga negativa.
Nucleófilos con Oxígeno
El agua (H2O) y los alcoholes son ejemplos comunes. Sus formas con carga negativa, como el hidróxido (-OH) y los alcóxidos, son nucleófilos aún más fuertes. Las sales de ácidos carboxílicos también pueden actuar como nucleófilos.
Nucleófilos con Nitrógeno
El amoniaco (NH3) y las aminas (compuestos similares al amoniaco pero con grupos de carbono) son buenos nucleófilos.
Nucleófilos con Azufre
El azufre también puede formar nucleófilos. Algunos ejemplos son el anión hidrogenosulfuro (HS-), los tioles (R-SH), los tiolatos (R-S-) y los sulfuros (R-S-R).
Véase también
 En inglés: Nucleophile Facts for Kids
En inglés: Nucleophile Facts for Kids