Ley general de los gases para niños
La ley combinada de los gases es una regla científica que une tres leyes importantes sobre cómo se comportan los gases: la ley de Charles, la ley de Boyle-Mariotte y la ley de Gay-Lussac. Estas leyes nos ayudan a entender cómo se relacionan la presión, el volumen y la temperatura de un gas.
Imagina que tienes un globo. Si lo aprietas, su volumen cambia. Si lo calientas, también cambia. La ley combinada de los gases nos ayuda a predecir estos cambios.
¿Qué es la Ley Combinada de los Gases?
La ley combinada de los gases nos dice que la relación entre la presión, el volumen y la temperatura de un gas siempre se mantiene constante, siempre y cuando la cantidad de gas no cambie. Es como una regla general que describe el comportamiento de muchos gases.
¿Cómo se Relacionan Presión, Volumen y Temperatura?
Para entender la ley combinada, primero debemos conocer las tres leyes que la forman:
La Ley de Boyle: Presión y Volumen
La Ley de Boyle explica que si mantienes la temperatura de un gas constante, su presión y su volumen se comportan de forma opuesta. Esto significa que si aumentas la presión sobre un gas (lo aprietas), su volumen disminuye. Y si reduces la presión, su volumen aumenta. Piensa en una jeringa: si tapas la salida y empujas el émbolo, el aire dentro se comprime (su volumen baja y su presión sube).
La Ley de Charles: Volumen y Temperatura
La Ley de Charles nos dice que si la presión de un gas se mantiene constante, su volumen y su temperatura absoluta (medida en kelvins) van de la mano. Si calientas un gas, su volumen se expande. Si lo enfrías, su volumen se encoge. Por ejemplo, un globo se desinfla un poco si lo metes en el congelador.
La Ley de Gay-Lussac: Presión y Temperatura
Finalmente, la Ley de Gay-Lussac explica que si el volumen de un gas se mantiene constante (por ejemplo, en un recipiente cerrado y rígido), su presión y su temperatura absoluta también van de la mano. Si calientas el gas, su presión aumenta. Si lo enfrías, su presión disminuye. Por eso, es peligroso calentar una lata de aerosol, ya que la presión interna podría subir mucho.
La Fórmula de la Ley Combinada de los Gases
La ley combinada de los gases se puede escribir con una fórmula matemática que une estas tres ideas:
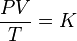
Donde:
- P es la presión del gas.
- V es el volumen del gas.
- T es la temperatura absoluta del gas (siempre en kelvins).
- K es una constante. Esto significa que, para una cantidad fija de gas, el resultado de dividir el producto de la presión y el volumen entre la temperatura siempre será el mismo.
Esta fórmula también se puede usar para comparar el estado de un gas en dos momentos diferentes:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac { P_1 V_1 }{ T_1 } = \frac { P_2 V_2 }{ T_2 }
Aquí, los números 1 y 2 se refieren a las condiciones del gas en un primer momento y en un segundo momento.
¿Para Qué Sirve la Ley Combinada de los Gases?
La ley combinada de los gases es muy útil para entender cómo funcionan muchas cosas en nuestra vida diaria. Por ejemplo:
- Los refrigeradores y los acondicionadores de aire usan los principios de estas leyes para enfriar el aire.
- La formación de nubes en el cielo también se explica en parte por cómo el aire (un gas) cambia de volumen y temperatura.
Ver también
- Ley de los gases ideales
- Proceso termodinámico
Véase también
 En inglés: Combined gas law Facts for Kids
En inglés: Combined gas law Facts for Kids

