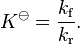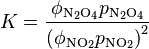Constante de equilibrio para niños
La constante de equilibrio es un número especial que nos ayuda a entender las reacciones químicas. Imagina una reacción donde algunas sustancias se transforman en otras, y luego esas nuevas sustancias pueden volver a transformarse en las originales. Esto se llama una reacción reversible.
Cuando una reacción reversible alcanza un punto donde la velocidad de formación de los productos es igual a la velocidad de formación de los reactivos, decimos que está en equilibrio químico. En este punto, las cantidades de cada sustancia ya no cambian. La constante de equilibrio es el valor que describe esta situación.
Este valor es muy útil porque, si conoces las condiciones de una reacción (como la temperatura), puedes usar la constante de equilibrio para predecir cuánto de cada sustancia habrá cuando la reacción alcance el equilibrio. Es como una "receta" que te dice las proporciones finales.
Conocer las constantes de equilibrio es clave para entender muchos procesos químicos, incluso algunos muy importantes en nuestro cuerpo, como la forma en que la hemoglobina transporta oxígeno en la sangre o cómo el cuerpo mantiene el equilibrio de ácidos y bases.
Dependiendo del tipo de reacción, la constante de equilibrio puede tener nombres específicos, como constantes de estabilidad, de formación, de unión o de disociación.
Contenido
- ¿Qué es la constante de equilibrio y cómo funciona?
- Tipos de constantes de equilibrio
- ¿Por qué la constante de equilibrio no tiene unidades?
- ¿Cómo afecta la temperatura a la constante de equilibrio?
- ¿Cómo afecta la presión a la constante de equilibrio?
- Efecto de la sustitución isotópica
- Véase también
¿Qué es la constante de equilibrio y cómo funciona?
Para entender mejor la constante de equilibrio, pensemos en una reacción química general donde las sustancias A y B se combinan para formar R y S, y viceversa:
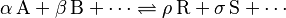
Aquí, las letras griegas (alfa, beta, etc.) son números que indican cuántas moléculas de cada sustancia participan en la reacción.
La constante de equilibrio, que a veces se escribe como 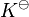 , es el valor que toma una medida llamada "cociente de reacción" cuando la reacción llega al equilibrio. En este punto, la energía libre de Gibbs (una medida de la energía disponible para hacer trabajo) de la reacción es cero, lo que significa que el sistema está en su estado más estable.
, es el valor que toma una medida llamada "cociente de reacción" cuando la reacción llega al equilibrio. En este punto, la energía libre de Gibbs (una medida de la energía disponible para hacer trabajo) de la reacción es cero, lo que significa que el sistema está en su estado más estable.
La constante de equilibrio se calcula usando las "actividades" de las sustancias en el equilibrio. La actividad es una forma de medir la cantidad efectiva de una sustancia en una mezcla, que es un poco más precisa que solo la concentración, especialmente en soluciones que no son muy diluidas.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): K^\ominus = \frac{{\mathrm{\{R\}}^\rho \mathrm{\{S\}}^\sigma...}}{{\mathrm{\{A\}}^\alpha \mathrm{\{B\}}^\beta...}}
Donde {X} representa la actividad de la sustancia X. Si la solución es muy diluida, podemos usar las concentraciones [X] en lugar de las actividades.
La constante de equilibrio también está relacionada con la energía libre estándar de Gibbs (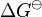 ) de la reacción mediante la siguiente fórmula:
) de la reacción mediante la siguiente fórmula:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Delta G^\ominus = -RT \ln (K^\ominus)
Aquí, R es la constante de los gases y T es la temperatura en Kelvin. Esta fórmula nos dice que la constante de equilibrio es un número puro, sin unidades, porque no se pueden sacar logaritmos de números con unidades.
¿Cómo se relaciona con la velocidad de las reacciones?
La constante de equilibrio también se puede entender a partir de las velocidades de las reacciones. Cuando una reacción reversible alcanza el equilibrio, la velocidad de la reacción que va hacia adelante (de reactivos a productos) es igual a la velocidad de la reacción que va hacia atrás (de productos a reactivos).
Si llamamos kf a la constante de velocidad de la reacción hacia adelante y kr a la constante de velocidad de la reacción hacia atrás, entonces la constante de equilibrio es simplemente la relación entre ellas:
Esto significa que si la reacción hacia adelante es mucho más rápida que la de atrás (kf es mucho mayor que kr), la constante de equilibrio será grande, indicando que en el equilibrio habrá muchos productos. Si es al revés, la constante será pequeña y habrá más reactivos.
Tipos de constantes de equilibrio
Existen diferentes tipos de constantes de equilibrio, dependiendo de la reacción que estemos estudiando.
Constantes de formación: paso a paso y totales
Cuando se forman complejos químicos (por ejemplo, un metal que se une a varias moléculas llamadas ligandos), la unión puede ocurrir en varios pasos. Cada paso tiene su propia constante de equilibrio, llamada constante de formación sucesiva.
Por ejemplo, si un metal (M) se une a un ligando (L): <chem>M + L <=> ML</chem> con constante 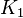 <chem>ML + L <=> ML2</chem> con constante
<chem>ML + L <=> ML2</chem> con constante 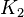 Y así sucesivamente.
Y así sucesivamente.
También podemos hablar de una constante de formación global (símbolo β), que considera la formación del complejo completo en un solo paso. Por ejemplo, para formar ML4:
- <chem>M + 4L <=> ML4</chem> con constante Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \beta_4
Las constantes globales son el producto de las constantes sucesivas: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \beta_4 = K_1 \cdot K_2 \cdot K_3 \cdot K_4 .
¿Cómo se usan las constantes de competencia?
A veces, es difícil medir directamente una constante de equilibrio. En esos casos, se puede usar un "método de competencia". Esto significa que se introduce otra sustancia que compite por unirse al mismo elemento. Midiendo las constantes de las reacciones más fáciles, se puede calcular la constante que nos interesa.
Constantes de asociación y disociación
En química, es común usar las constantes de disociación ácida, llamadas pKa. Estas nos dicen qué tan fácilmente un ácido libera iones de hidrógeno (H+).
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{p}K_\mathrm{a}=-\log (K_{\mathrm{dis}})
Un valor de pKa bajo significa que el ácido es fuerte y se disocia fácilmente. Para las bases, se usa pKb.
Por otro lado, las constantes de estabilidad para complejos metálicos o la unión entre moléculas se suelen expresar como constantes de asociación, que indican qué tan fuerte se unen las sustancias.
Microconstantes: cuando hay varias opciones
Cuando una molécula tiene varios lugares donde puede ocurrir una reacción (por ejemplo, donde puede unirse un ion de hidrógeno), existen varias constantes de equilibrio posibles. Estas se llaman microconstantes.
Por ejemplo, una molécula como la L-DOPA tiene dos grupos que pueden perder un ion de hidrógeno. Cada uno de estos grupos tiene su propia microconstante. La constante de equilibrio que medimos en total (la macroconstante) es la suma de estas microconstantes.
Las microconstantes son importantes porque nos dan detalles sobre cómo reacciona una molécula en cada uno de sus sitios. Sin embargo, no siempre son fáciles de medir por separado.
El pH y las constantes de Brønsted
El pH es una medida de la acidez o basicidad de una solución, y se define usando la actividad de los iones de hidrógeno.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): pH = -\log_{10}\ \boldsymbol{\alpha}_{H^+}
Cuando medimos el pH con un electrodo, a veces obtenemos una "constante de equilibrio mixta" o constante de Brønsted, que combina la actividad de los iones de hidrógeno con las concentraciones de otras sustancias.
Constantes condicionales: para condiciones específicas
Las constantes condicionales, también llamadas constantes aparentes, son valores que se usan para describir el equilibrio bajo condiciones muy específicas, como un pH fijo. No son constantes de equilibrio "verdaderas" porque su valor cambia si las condiciones cambian.
Por ejemplo, en bioquímica, muchas constantes de equilibrio se miden a un pH específico usando una solución tampón. Estas constantes son condicionales y pueden variar si se usa un tampón diferente.
Equilibrios en gases
Para reacciones que ocurren en una fase gaseosa, las constantes de equilibrio se pueden definir usando las presiones parciales de los gases (la presión que cada gas ejerce en la mezcla).
Aquí, p es la presión parcial y ϕ es un factor llamado coeficiente de fugacidad.
¿Por qué la constante de equilibrio no tiene unidades?
Aunque a veces veas constantes de equilibrio con unidades (como mol/litro), en realidad, una constante de equilibrio termodinámica siempre debe ser un número sin unidades (adimensional). Esto se debe a que está relacionada con el logaritmo de la energía libre de Gibbs, y solo se pueden sacar logaritmos de números puros.
Cuando se usan concentraciones en lugar de actividades para calcular la constante, puede parecer que tiene unidades. Sin embargo, esto se debe a que se asume que los factores que harían que la constante fuera adimensional (los coeficientes de actividad) son constantes o se incluyen en la definición de la constante.
¿Cómo afecta la temperatura a la constante de equilibrio?
La temperatura es uno de los factores más importantes que afectan el valor de la constante de equilibrio. Si conoces la constante de equilibrio a una temperatura y el cambio de entalpía (el calor absorbido o liberado) de la reacción, puedes calcular la constante a otra temperatura.
La relación se describe con la ecuación de van't Hoff:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \ln K_2 = \ln K_1 -\frac{\Delta H^\ominus}{R} \left(\frac{1}{T_2}-\frac{1}{T_1}\right)
Esta ecuación nos dice que:
- Para una reacción que libera calor (exotérmica), si aumentas la temperatura, la constante de equilibrio disminuye. Esto significa que se formarán menos productos.
- Para una reacción que absorbe calor (endotérmica), si aumentas la temperatura, la constante de equilibrio aumenta. Esto significa que se formarán más productos.
Esto concuerda con el Principio de Le Châtelier, que dice que un sistema en equilibrio reaccionará para contrarrestar un cambio. Si añades calor (aumentas la temperatura), el sistema intentará absorberlo.
¿Cómo afecta la presión a la constante de equilibrio?
La presión generalmente tiene un efecto pequeño en la constante de equilibrio, especialmente para líquidos y sólidos. Sin embargo, para las reacciones en fase gaseosa, la presión sí puede influir en la composición de la mezcla en equilibrio, aunque no cambie el valor de la constante de equilibrio en sí.
Si una reacción gaseosa produce un cambio en el número total de moléculas de gas (por ejemplo, 4 moléculas se convierten en 2), un aumento de la presión favorecerá la dirección que produce menos moléculas de gas. Esto también sigue el Principio de Le Châtelier.
Efecto de la sustitución isotópica
Si reemplazas un átomo en una molécula por un isótopo más pesado (por ejemplo, hidrógeno por deuterio), esto puede cambiar el valor de la constante de equilibrio. Esto se debe a que los isótopos tienen masas diferentes, lo que afecta la energía de vibración de los enlaces químicos.
Por ejemplo, si un átomo de hidrógeno se reemplaza por deuterio en un ácido, el ácido deuterado en agua pesada (D2O) será más débil que el ácido original en agua normal (H2O). Esto significa que su constante de disociación ácida será menor.
Véase también
 En inglés: Equilibrium constant Facts for Kids
En inglés: Equilibrium constant Facts for Kids
- Determinación de constantes de equilibrio
- Constantes de estabilidad de complejos
- Química del equilibrio