Deslocalización electrónica para niños
La deslocalización electrónica es un concepto en física y química que describe cómo los electrones no siempre están fijos en un solo átomo o en un solo enlace covalente. En cambio, pueden moverse o distribuirse entre varios átomos o enlaces dentro de una molécula, un ion o un metal.
Imagina que los electrones son como pequeños exploradores. En algunos materiales, cada explorador está atado a un solo árbol (un átomo). Pero en otros, los exploradores pueden moverse libremente entre varios árboles o incluso por todo un bosque. Esa libertad de movimiento es la deslocalización electrónica.
Este concepto es muy útil para entender por qué algunas sustancias tienen propiedades especiales, como la capacidad de conducir electricidad o su forma y estabilidad.
Contenido
Resonancia en las Moléculas
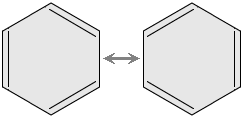
En la química orgánica, la deslocalización es clave para entender la resonancia, especialmente en moléculas como el benceno. El benceno tiene una forma de anillo con seis átomos de carbono. Si los electrones estuvieran fijos, algunos enlaces serían dobles y otros simples, lo que haría que tuvieran diferentes longitudes.
Sin embargo, en el benceno, seis electrones se mueven libremente alrededor de todo el anillo. Esto hace que todos los enlaces entre los átomos de carbono sean exactamente iguales en longitud y fuerza. Es como si los electrones estuvieran en una pista circular, compartiéndose por igual entre todos los átomos de carbono. Por eso, a menudo se dibuja un círculo dentro del anillo de benceno para representar esta deslocalización.
Electrones y Electricidad
La deslocalización electrónica también explica por qué algunos materiales son buenos conductores de electricidad.
Metales: Un Mar de Electrones
En los metales sólidos, los átomos están organizados de una manera especial. Sus electrones más externos no están unidos a un solo átomo, sino que se mueven libremente por toda la estructura, como un "mar" de electrones. Esta libertad de movimiento permite que los electrones se desplacen fácilmente cuando se aplica una corriente eléctrica, lo que hace que los metales sean excelentes conductores de electricidad.
Diamante vs. Grafito: La Diferencia en la Conducción
- Diamante: En el diamante, cada átomo de carbono está fuertemente unido a otros cuatro átomos de carbono. Los electrones de cada átomo están "atrapados" en estos enlaces. Como no pueden moverse libremente, el diamante no conduce la electricidad.
- Grafito: El grafito (el material de las minas de lápiz) también está hecho de carbono, pero sus átomos se organizan de manera diferente. Cada átomo de carbono se une a solo otros tres, formando capas planas. El cuarto electrón de cada átomo de carbono no está fijo en un enlace, sino que se deslocaliza y puede moverse por toda la capa. Esto permite que el grafito conduzca la electricidad a lo largo de sus capas, pero no a través de ellas.
Véase también
 En inglés: Delocalized electron Facts for Kids
En inglés: Delocalized electron Facts for Kids
- Aromaticidad (un tipo especial de deslocalización de electrones en anillos de átomos)