Pentafluoruro de antimonio para niños
Datos para niños
Pentafluoruro de antimonio |
||
|---|---|---|
| General | ||
| Fórmula estructural | 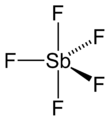 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7783-70-2 | |
| Número RTECS | CC5800000 | |
| ChEBI | 193146 | |
| ChemSpider | 14846333 22963, 14846333 | |
| PubChem | 90479450 24557, 90479450 | |
| UNII | 6C93R71VRF | |
|
InChI
InChI=InChI=1S/5FH.Sb/h5*1H;/q;;;;;+5/p-5
Key: VBVBHWZYQGJZLR-UHFFFAOYSA-I |
||
| Propiedades físicas | ||
| Masa molar | 215,8958318 g/mol | |
El pentafluoruro de antimonio es un compuesto inorgánico con la fórmula SbF5. Es un líquido espeso y sin color. Este compuesto es muy importante en la química porque es un ácido de Lewis muy fuerte.
También es un ingrediente clave en el ácido fluoroantimónico. Este ácido se forma al mezclar fluoruro de hidrógeno líquido con pentafluoruro de antimonio líquido. Es conocido como uno de los ácidos más fuertes que existen. El pentafluoruro de antimonio puede reaccionar con casi cualquier otro compuesto.
Contenido
¿Cómo se obtiene el pentafluoruro de antimonio?
El pentafluoruro de antimonio se puede preparar de varias maneras. Una forma es haciendo reaccionar el pentacloruro de antimonio con fluoruro de hidrógeno sin agua.
La reacción se ve así:
- SbCl5 + 5HF → SbF5 + 5HCl
También se puede obtener usando trifluoruro de antimonio y flúor.
Estructura y cómo reacciona
En estado gaseoso, el SbF5 tiene una forma especial llamada bipiramidal trigonal. Puedes ver su estructura en la imagen de arriba.
Cuando está en estado líquido o sólido, su estructura es más compleja. En el líquido, forma cadenas largas llamadas polímeros. En estas cadenas, cada átomo de antimonio (Sb) está rodeado por seis átomos de flúor (F).
En estado cristalino (sólido), el material forma grupos de cuatro moléculas, llamados tetrámeros. Estos grupos tienen la fórmula [SbF4(μ-F)]4. Los enlaces entre el antimonio y el flúor dentro de estos grupos son de una longitud específica.
Otros compuestos parecidos, como el PF5 y el AsF5, no forman estas cadenas o grupos grandes. Esto se debe a que sus átomos centrales son más pequeños. Sin embargo, el BiF5 sí forma polímeros.
El pentafluoruro de antimonio no solo aumenta la fuerza de los ácidos como el HF, sino que también hace que el flúor (F2) sea un oxidante más potente. Esto significa que puede quitar electrones a otras sustancias con más facilidad.
Por ejemplo, puede oxidar el oxígeno:
- 2SbF5 + F2 +2O2 → 2[O2 ]+[SbF6]-
Este compuesto también fue usado en el primer experimento que logró producir gas flúor a partir de otros compuestos de flúor.
La razón por la que el SbF5 es tan reactivo es que tiene una gran atracción por los iones de flúor (F-). Esta misma propiedad lo hace útil para crear superácidos.
El hexafluoroantimonato: un anión especial
El SbF5 es un ácido de Lewis muy fuerte. Esto significa que es muy bueno aceptando pares de electrones. Es especialmente fuerte cuando se une a iones de flúor (F-). Cuando esto sucede, forma un anión muy estable llamado hexafluoroantimonato, con la fórmula [SbF6]-.
Este anión es un anión débilmente coordinado, lo que significa que no se une fuertemente a otras sustancias. Aunque es débilmente básico, puede reaccionar con más SbF5 para formar una estructura más grande:
- SbF
5 + [SbF
6]- → [Sb
2F
11]-
Precauciones de seguridad
El pentafluoruro de antimonio es un químico que debe manejarse con mucho cuidado. Reacciona de forma enérgica con muchos compuestos. Durante estas reacciones, a menudo puede liberar fluoruro de hidrógeno, que es un gas que requiere precauciones especiales.
Es importante saber que este compuesto puede causar irritación si entra en contacto con la piel o los ojos. Por eso, siempre se deben usar equipos de protección adecuados al trabajar con él en un laboratorio.
Véase también
 En inglés: Antimony pentafluoride Facts for Kids
En inglés: Antimony pentafluoride Facts for Kids

