Experimento de Luria y Delbrück para niños
El test de fluctuación, también conocido como el experimento de Luria y Delbrück, demostró algo muy importante sobre las bacterias: que los cambios en su ADN (llamados mutaciones) ocurren al azar, sin que el ambiente las provoque. Esto significa que las bacterias no "deciden" mutar para adaptarse a un peligro, sino que las mutaciones ya existen antes de que el peligro aparezca.
Este descubrimiento fue clave porque confirmó que la teoría de la selección natural de Charles Darwin (que dice que los seres vivos con características útiles para sobrevivir tienen más probabilidades de reproducirse) también se aplica a organismos muy pequeños como las bacterias. Por este trabajo, Max Delbrück y Salvador Edward Luria recibieron el Premio Nobel en Fisiología o Medicina en 1969.
Contenido
¿Cómo surgió la idea del experimento?
En la década de 1940, los científicos ya sabían que los seres vivos heredaban características y que podían tener mutaciones. Sin embargo, no se entendía bien cómo funcionaba el ADN ni si las bacterias eran diferentes. Se pensaba que quizás las bacterias podían desarrollar mutaciones específicas para adaptarse a las condiciones de su entorno.
La gran pregunta era: ¿las mutaciones en las bacterias aparecen *antes* de que las necesiten (pre-adaptativas) o *después* y como una respuesta directa al ambiente (post-adaptativas)? Salvador Luria estaba muy interesado en resolver esta duda. La idea para el experimento se le ocurrió mientras observaba una máquina de juegos en un baile en la Universidad de Indiana.
El experimento paso a paso
Para su experimento, Luria y Delbrück usaron una bacteria común llamada Escherichia coli. Hicieron lo siguiente:
- Primero, pusieron una pequeña cantidad de bacterias en varios tubos de cultivo separados.
- Dejaron que las bacterias crecieran por un tiempo en cada tubo.
- Luego, tomaron la misma cantidad de bacterias de cada tubo y las colocaron en diferentes placas con un tipo de gel llamado agar.
- A este gel le habían añadido un virus llamado T1. Este virus ataca y mata a las bacterias, a menos que sean resistentes.
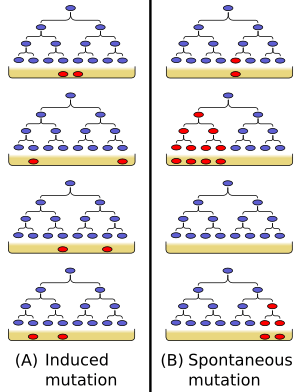
Si las bacterias se volvieran resistentes al virus solo cuando entraban en contacto con él (es decir, si la resistencia fuera una respuesta directa al virus), entonces cada placa debería tener un número similar de bacterias resistentes que sobrevivieran.
¿Qué resultados obtuvieron?
Pero Luria y Delbrück no encontraron eso. En lugar de tener un número similar de bacterias resistentes en cada placa, el número variaba muchísimo de una placa a otra. Algunas placas tenían muy pocas bacterias resistentes, mientras que otras tenían muchísimas.
Esto les hizo pensar que las mutaciones que daban resistencia al virus no aparecían como una respuesta al virus, sino que ya estaban presentes en las bacterias antes de que el virus llegara. Si una mutación de resistencia aparecía temprano en el crecimiento de un tubo, esa bacteria resistente se multiplicaría mucho, dando lugar a muchas bacterias resistentes en esa placa. Si la mutación aparecía tarde, habría pocas. Si no aparecía, no habría ninguna. Esto explicaba la gran variación entre las placas.
La conclusión fue clara: las mutaciones en las bacterias (y en otros organismos) son aleatorias, no dirigidas por el ambiente.
Confirmación de los resultados
Otro científico, Newcombe, confirmó estos resultados de una manera visual. Él cultivó bacterias en una placa de Petri y luego las "copió" en otras dos placas nuevas que contenían el virus.
- Una de las nuevas placas se dejó tal cual.
- En la otra, las bacterias se extendieron un poco más.
Si las bacterias resistentes ya existían antes de entrar en contacto con el virus, la placa donde se extendieron las bacterias debería tener más colonias resistentes, porque las bacterias resistentes se habrían movido y formado nuevas colonias. Y eso fue exactamente lo que pasó: la placa extendida tuvo 50 veces más colonias resistentes. Esto demostró que las mutaciones que daban resistencia al virus ya habían ocurrido al azar durante el primer cultivo, antes de que el virus fuera aplicado.
La resistencia de las bacterias
La resistencia de las bacterias al virus T1 se debe a cambios en un gen llamado fhuA. Este gen produce una proteína que se encuentra en la superficie de la bacteria y que normalmente ayuda a transportar ciertas sustancias. Pero esta proteína también es la "puerta de entrada" para el virus T1. Si el gen fhuA muta, la proteína cambia y el virus ya no puede entrar en la bacteria, lo que la hace resistente.
Esta proteína FhuA es muy importante para la bacteria, ya que también participa en el transporte de otras moléculas y es un receptor para otros virus.
Véase también
 En inglés: Luria–Delbrück experiment Facts for Kids
En inglés: Luria–Delbrück experiment Facts for Kids

