Enlace peptídico para niños
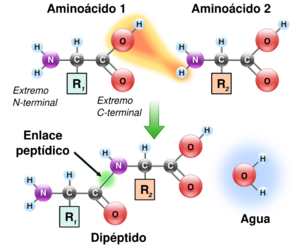
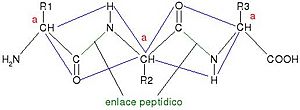
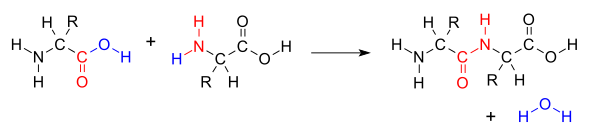
El enlace peptídico es un tipo de unión química muy importante en la biología. Imagina que los aminoácidos son como pequeños bloques de construcción. Cuando dos de estos bloques se unen, lo hacen a través de un enlace peptídico. Este enlace se forma entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro.
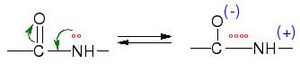
Los péptidos y las proteínas, que son esenciales para la vida, están hechos de muchos aminoácidos unidos por estos enlaces. Al formarse el enlace peptídico, se crea una unión CO-NH y se libera una molécula de agua (H2O). Es como si los aminoácidos se "pegaran" y soltaran un poco de agua. Para que este enlace se forme, se necesita energía. Sin embargo, cuando el enlace se rompe, se libera energía.
Podemos seguir añadiendo aminoácidos a un péptido. Siempre se añaden en el extremo que tiene el grupo COOH libre. Para nombrar un péptido, se empieza por el aminoácido que tiene el grupo NH2 libre. Por ejemplo, si el primer aminoácido es alanina y el segundo es serina, el péptido se llamaría alanil-serina.
Contenido
¿Cómo es el enlace peptídico por dentro?
En los años 1940 y 1950, unos científicos llamados Linus Pauling y Robert Corey estudiaron los enlaces peptídicos. Usaron una técnica llamada difracción de rayos X para ver cómo estaban organizados los átomos. Descubrieron cosas muy interesantes:
- El enlace C-N que une a dos aminoácidos es más corto que otros enlaces similares.
- Este enlace C-N es especial porque no permite que los átomos giren libremente. Es como si estuviera "fijo" en su posición.
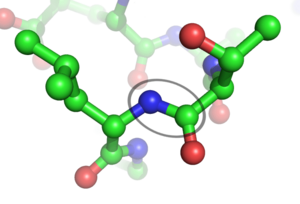
- Los cuatro átomos principales del enlace (carbono, oxígeno, nitrógeno e hidrógeno) se encuentran en el mismo plano, como si estuvieran sobre una mesa plana. El oxígeno y el hidrógeno están en lados opuestos.
Esta forma plana y rígida es muy importante. Hace que la estructura de un péptido sea como una serie de planos conectados. Aunque el enlace peptídico en sí no gira, otras partes de la cadena de aminoácidos sí pueden hacerlo. Sin embargo, no todos los giros son posibles. Esto limita las formas que una proteína puede adoptar, lo cual es crucial para su función.
Los científicos usan letras griegas, como "Φ" y "Ψ", para describir los ángulos de giro permitidos en la cadena de aminoácidos. Estos ángulos dependen mucho del tamaño y las características de los grupos laterales de cada aminoácido.
¿Cómo se rompe el enlace peptídico?
El enlace peptídico se puede romper añadiendo agua. Este proceso se llama hidrólisis. Cuando se rompe, se libera una pequeña cantidad de energía. En la naturaleza, este proceso es muy lento, puede tardar más de mil años. Pero hay formas de acelerarlo:
Hidrólisis con ácidos o bases
- Hidrólisis ácida: Se hierve la proteína con ácidos fuertes. Este método es muy potente, pero puede dañar algunos aminoácidos.
- Hidrólisis básica: Se usan bases fuertes. Este método es útil porque protege los aminoácidos que se dañan con los ácidos.
Hidrólisis con enzimas
- Hidrólisis enzimática: Esta es la forma más común en los seres vivos. Se usan unas proteínas especiales llamadas enzimas proteolíticas. Estas enzimas son muy específicas y rompen los enlaces de forma controlada, sin dañar los aminoácidos. Por ejemplo, la tripsina y la quimotripsina son enzimas que ayudan a digerir las proteínas en nuestro cuerpo.
Hidrólisis por temperatura
Normalmente, las altas temperaturas no rompen los enlaces peptídicos. Sin embargo, pueden hacer que la proteína pierda su forma tridimensional (esto se llama desnaturalización). Pero si la temperatura es extremadamente alta y se mantiene por mucho tiempo (más de 110 grados Celsius por 48 horas), sí puede llegar a romper los enlaces peptídicos.
Véase también
 En inglés: Peptide bond Facts for Kids
En inglés: Peptide bond Facts for Kids
- Aminoácido
- Enlace químico
- Momento dipolar
- Proteína
- Proteólisis
- Sacarosa
- Síntesis proteica