Conductividad molar para niños
La conductividad molar es una medida de qué tan bien una sustancia disuelta en un líquido (llamada electrolito) puede conducir la electricidad. Imagina que tienes agua con sal disuelta; la sal se separa en pequeñas partículas cargadas llamadas iones. La conductividad molar nos dice qué tan eficientemente esos iones transportan la corriente eléctrica, y esto depende de cuántos iones hay y de qué tipo son. Algunos iones son mejores conductores que otros.
Contenido
¿Qué es la Conductividad Molar?
La conductividad molar (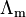 ) se basa en la concentración o molaridad de los iones en una solución. Es una propiedad única para cada tipo de ion en soluciones acuosas y está directamente relacionada con la velocidad a la que los iones se mueven durante la electrólisis (cuando la electricidad pasa a través de la solución).
) se basa en la concentración o molaridad de los iones en una solución. Es una propiedad única para cada tipo de ion en soluciones acuosas y está directamente relacionada con la velocidad a la que los iones se mueven durante la electrólisis (cuando la electricidad pasa a través de la solución).
¿Cómo se Calcula la Conductividad Molar?
Para entender la conductividad molar, primero necesitamos conocer la conductividad específica (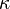 ) de una solución. Esta se puede medir con equipos especiales. La conductividad específica nos dice qué tan bien conduce la electricidad una porción específica de la solución.
) de una solución. Esta se puede medir con equipos especiales. La conductividad específica nos dice qué tan bien conduce la electricidad una porción específica de la solución.
El físico alemán Friedrich Kohlrausch, quien estudió mucho cómo los electrolitos conducen la electricidad, propuso una forma de comparar la conductividad de diferentes sustancias. Él definió la conductividad molar (antes llamada "conductividad equivalente") con esta fórmula:
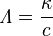
Aquí, 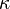 es la conductividad específica (medida en siemens por centímetro, S·cm-1) y
es la conductividad específica (medida en siemens por centímetro, S·cm-1) y  es la concentración del electrolito.
es la concentración del electrolito.
Originalmente, la concentración se medía en "equivalente-gramo" por centímetro cúbico. Sin embargo, hoy en día los químicos usan más el mol como unidad de cantidad de sustancia. Así que, ahora,  se refiere a la concentración en moles por centímetro cúbico.
se refiere a la concentración en moles por centímetro cúbico.
Las unidades más comunes para la conductividad molar son S·cm2·mol-1. En el Sistema Internacional de Unidades (SI), lo correcto sería S·m2·mol-1.
Como las concentraciones de las soluciones químicas suelen darse en moles por litro (1000 cm3), la fórmula se puede escribir de una forma más práctica:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Lambda = \frac{1000\cdot\kappa}{M}
Donde 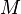 es la molaridad, que es el número de moles de la sustancia disuelta por cada litro de solución. Esto hace que calcular la conductividad molar sea más fácil.
es la molaridad, que es el número de moles de la sustancia disuelta por cada litro de solución. Esto hace que calcular la conductividad molar sea más fácil.
Ejemplo de Cálculo
Imagina que tienes una solución de cloruro de potasio (KCl) en agua a 25 °C. Su concentración es de 1.00 mol por decímetro cúbico (que es lo mismo que 1.00 mol por litro). La conductividad específica (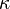 ) de esta solución es 0.112 S·cm-1.
) de esta solución es 0.112 S·cm-1.
Para calcular la conductividad molar del KCl en esta solución, usamos la fórmula:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Lambda = \frac{1000\cdot 0,112}{1}\frac{cm^3\cdot S \cdot cm^{-1} }{mol} = 112 \ S\cdot cm^2 \cdot mol^{-1}
Así, la conductividad molar de esta solución de KCl es 112 S·cm2·mol-1.
Conductividad Molar a Dilución Infinita
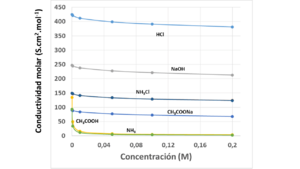
Cuando una solución está muy, muy diluida (es decir, tiene muy poca cantidad de la sustancia disuelta), la conductividad molar alcanza un valor especial llamado conductividad molar a dilución infinita o conductividad molar límite (Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Lambda^\infty ). Esto ocurre cuando la concentración ( ) se acerca a cero.
) se acerca a cero.
Para los electrolitos fuertes (sustancias que se disuelven completamente en iones), este valor se puede encontrar graficando la conductividad molar contra la raíz cuadrada de la concentración. Esto se conoce como la ley de Kohlrausch:
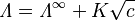
Donde 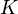 es una constante y
es una constante y  es la concentración.
es la concentración.
Si el electrolito es débil (no se disuelve completamente en iones), se usa otra fórmula llamada la ley de dilución de Ostwald:
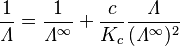
Aquí, 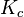 es la constante de equilibrio de la sustancia.
es la constante de equilibrio de la sustancia.
Valores Típicos de Conductividad Molar
Aquí tienes una tabla con algunos valores de conductividad molar límite para diferentes iones en agua a 25 °C. Estos valores nos muestran qué tan bien conduce la electricidad cada tipo de ion cuando está muy diluido.
| Catión | Λ0+(S·cm²mol−1) | Anión |
Λ0−(S·cm²mol−1) |
|---|---|---|---|
| H+ | 349,8 | OH− | 198,6 |
| Li+ | 38,7 | F− | 55,4 |
| Na+ | 50,1 | Cl− | 76,4 |
| K+ | 73,5 | Br− | 78,1 |
| Rb+ | 77,8 | I− | 76,8 |
| Cs+ | 77.3 | NO3− | 71,5 |
| Ag+ | 61,9 | ClO3− | 64,6 |
| NH4+ | 73,4 | ClO4− | 67,4 |
| N(C2H5)4+ | 32,4 | HCO3− | 44,5 |
| 1/2 Mg2+ | 53,1 | HCOO− | 54,6 |
| 1/2 Ca2+ | 59,5 | CH3COO− | 40,9 |
| 1/2 Ba2+ | 63,6 | 1/2 SO42− | 80,0 |
| 1/2 Cu2+ | 53,6 | 1/2 CO32− | 69,3 |
| 1/3 La3+ | 69,7 | 1/3 Fe(CN)63− | 100,9 |
| 1/3 Ce3+ | 69,8 | 1/2 (C2O4)2− | 74,2 |
Véase también
 En inglés: Molar conductivity Facts for Kids
En inglés: Molar conductivity Facts for Kids
- Conductividad eléctrica
- Conductividad (electrolítica)
- Conductimetría
- Conductímetro
- Molaridad