Átomo de hidrógeno para niños
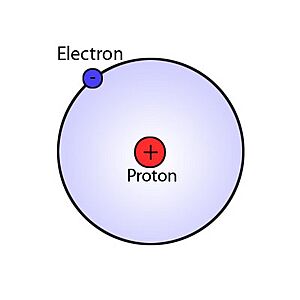
El átomo de hidrógeno es el átomo más sencillo que existe. Es como el "bloque de construcción" más básico de toda la materia. Está formado por un protón en su centro, que es como el "sol" del átomo, y un solo electrón que se mueve alrededor de él, como un pequeño "planeta". El protón es mucho más pesado que el electrón.
A veces, el átomo de hidrógeno puede tener también uno o dos neutrones junto al protón en su centro. Cuando tiene un neutrón, se llama deuterio, y cuando tiene dos, se llama tritio. El hidrógeno normal, sin neutrones, se llama protio.
Contenido
¿Por qué el átomo de hidrógeno es tan especial?
Desde hace mucho tiempo, los científicos se preguntaban cómo funcionaban los átomos. Al principio del siglo XX, se dieron cuenta de que las leyes de la física clásica (las que usamos para entender cómo se mueven los objetos grandes) no podían explicar por qué los átomos eran estables.
Según esas leyes, un electrón que gira alrededor de un protón debería perder energía y caer rápidamente hacia el centro del átomo. ¡Esto significaría que los átomos no durarían casi nada! Pero sabemos que los átomos son muy estables y existen por todas partes. Este misterio llevó a los científicos a buscar una nueva forma de entender el mundo a escala muy pequeña, y así nació la mecánica cuántica.
El modelo cuántico: una nueva forma de ver el átomo
La mecánica cuántica es una rama de la física que nos ayuda a entender cómo se comportan las partículas muy pequeñas, como los electrones y los protones. Con ella, los científicos pudieron explicar por qué el átomo de hidrógeno es estable y cómo se organizan los electrones a su alrededor.
En lugar de pensar en el electrón como un planeta que gira en una órbita fija, la mecánica cuántica lo describe con una "función de onda". Esta función nos dice dónde es más probable encontrar al electrón en un momento dado, pero no nos da una posición exacta. Es como una "nube de probabilidad" alrededor del núcleo.
Gracias a la mecánica cuántica, se pudo calcular la energía que tienen los electrones en el átomo de hidrógeno. Estas energías no pueden ser cualquier valor, sino que están "cuantizadas", lo que significa que solo pueden tener ciertos valores específicos. Esto es como si el electrón solo pudiera estar en escalones de una escalera, y no entre ellos.
Niveles de energía del hidrógeno
Los niveles de energía del átomo de hidrógeno se describen con un número especial llamado número cuántico principal, que se representa con la letra n. Este número puede ser 1, 2, 3, y así sucesivamente. Cuanto mayor es n, mayor es la energía del electrón y más lejos del núcleo se encuentra en promedio.
Los cálculos de la mecánica cuántica coinciden perfectamente con lo que se observa en los experimentos, como las luces que emiten los átomos de hidrógeno cuando se les da energía.
Átomos parecidos al hidrógeno
El mismo modelo cuántico que funciona para el hidrógeno también se puede usar para otros átomos que tienen un solo electrón, pero un núcleo con más protones. A estos se les llama átomos hidrogenoides. Por ejemplo, un átomo de helio al que le han quitado uno de sus dos electrones se comporta de manera similar al hidrógeno.
Pequeñas correcciones en el modelo
Aunque el modelo cuántico básico del átomo de hidrógeno es muy bueno, los científicos descubrieron que las líneas de luz que emiten los átomos son un poco más complejas de lo que se pensaba. Esto se debe a que hay otros efectos muy pequeños que también influyen en el electrón:
- El espín del electrón: El electrón se comporta como si estuviera girando sobre sí mismo, creando un pequeño campo magnético.
- Efectos de la relatividad: Cuando el electrón se mueve muy rápido, las leyes de la relatividad de Einstein también tienen un pequeño efecto en su energía.
- Otras interacciones: Hay otras interacciones muy sutiles entre el electrón y el núcleo.
Todas estas pequeñas correcciones hacen que los niveles de energía se dividan en subniveles aún más finos, algo que los científicos llaman "estructura fina" e "hiperfina". Esto demuestra lo preciso que es el estudio de los átomos.
Tipos de átomos de hidrógeno
El hidrógeno tiene tres isótopos principales, que son como "versiones" del mismo elemento con diferente número de neutrones en su núcleo:
- Protio (1H): Es el más común. Su núcleo tiene solo un protón. Es muy estable.
- Deuterio (2H): Su núcleo tiene un protón y un neutrón. Es estable, pero mucho menos común que el protio (solo un 0.015% del hidrógeno natural). A veces se le llama "hidrógeno pesado".
- Tritio (3H): Su núcleo tiene un protón y dos neutrones. Es inestable y se desintegra con el tiempo, transformándose en un átomo de helio, un electrón y una partícula muy pequeña llamada antineutrino electrónico.

Galería de imágenes
Véase también
 En inglés: Hydrogen atom Facts for Kids
En inglés: Hydrogen atom Facts for Kids