Solvatación para niños
La solvatación es un proceso químico muy interesante que ocurre cuando una sustancia se disuelve en otra. Imagina que tienes sal (el soluto) y la pones en agua (el disolvente). Cuando la sal se disuelve, sus partículas se separan y son rodeadas por las moléculas de agua. ¡Eso es la solvatación! Es la forma en que las moléculas del disolvente interactúan y envuelven a las partículas del soluto, ayudándolas a dispersarse y mezclarse.
Contenido
¿Qué es la solvatación y cómo se diferencia de la disolución y la solubilidad?
Es fácil confundir estos términos, pero son diferentes y muy importantes en química.
¿Qué es la disolución?
La disolución es el proceso general de mezclar un soluto con un disolvente para formar una solución. Por ejemplo, cuando pones azúcar en tu leche y la revuelves, estás disolviendo el azúcar. Es el acto de hacer que una sustancia se incorpore a otra.
¿Qué es la solubilidad?
La solubilidad se refiere a la cantidad máxima de soluto que se puede disolver en una cantidad específica de disolvente a una temperatura determinada. Es como el "límite" de cuánto puedes disolver. Si intentas añadir más azúcar de la que puede disolver tu leche, verás que parte del azúcar se quedará en el fondo sin disolverse. Esa cantidad máxima que sí se disuelve es la solubilidad.
¿Cómo explica la solvatación lo que ocurre a nivel molecular?
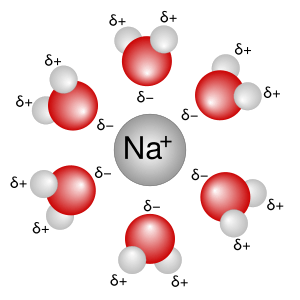
La solvatación es lo que sucede a un nivel muy pequeño, entre las moléculas. Es la interacción específica entre las moléculas del disolvente y las partículas del soluto. Cuando un soluto se disuelve, sus iones o moléculas se separan y las moléculas del disolvente los rodean y los mantienen estables en la solución. Es como si las moléculas del disolvente formaran un "abrazo" alrededor de las partículas del soluto para que no se vuelvan a unir.
¿Qué tipos de disolventes existen y cómo interactúan con los solutos?
Los disolventes pueden ser de diferentes tipos, y su forma de interactuar con los solutos depende de sus características.
¿Qué son los disolventes polares?
Los disolventes polares son aquellos cuyas moléculas tienen una parte con una pequeña carga positiva y otra con una pequeña carga negativa. El agua es el disolvente polar más conocido y el que más estudiamos. Otros ejemplos son el alcohol (metanol, etanol) o la acetona. Estos disolventes son muy buenos para disolver sustancias que también tienen cargas, como las sales (compuestos inorgánicos). Esto ocurre porque las partes cargadas del disolvente se sienten atraídas por las partes cargadas del soluto, como pequeños imanes.
¿Qué tipos de interacciones ocurren durante la solvatación?
Durante la solvatación, las moléculas del disolvente y del soluto interactúan de varias maneras:
- Puentes de hidrógeno: Son un tipo especial de atracción que ocurre en disolventes como el agua.
- Interacciones ion-dipolo: Suceden cuando un ion (una partícula con carga) es atraído por una molécula polar del disolvente.
- Interacciones dipolo-dipolo: Ocurren entre dos moléculas polares.
- Fuerzas de London: Son atracciones más débiles que ocurren entre todas las moléculas, incluso las no polares.
Para que la solvatación ocurra y sea favorable, la energía total del sistema (soluto + disolvente) debe ser menor después de que se mezclan que antes. Esto significa que el proceso libera energía o es energéticamente "cómodo" para las moléculas.
¿Cómo influye la energía en la solvatación?
La energía juega un papel muy importante en si una sustancia se disolverá o no.
¿Qué energía se necesita para disolver un soluto?
Para que un soluto se disuelva, primero hay que "romper" las uniones que mantienen unidas a sus partículas en su estado original (por ejemplo, en un cristal de sal). Esto requiere energía. Pero al mismo tiempo, se libera energía cuando las partículas del soluto se asocian con las moléculas del disolvente. Esta energía liberada se llama energía de solvatación.
¿Qué es la entalpía de disolución?
La entalpía de disolución es el cambio de energía térmica que ocurre cuando una sustancia se disuelve. Si este valor es negativo, significa que el proceso libera calor y es más probable que la sustancia se disuelva. Si es positivo, significa que necesita calor para disolverse. Por ejemplo, la mayoría de los gases se disuelven mejor en líquidos fríos porque su entalpía de disolución es negativa.
¿Por qué algunos iones se disuelven mejor que otros?
Aunque se podría pensar que los iones más pequeños y con más carga se disolverían mejor, no siempre es así. Algunos iones, como los de hierro o los lantánidos, reaccionan rápidamente con el agua para formar sustancias que no se disuelven fácilmente. La capacidad de un disolvente para solvatar un soluto se puede medir con algo llamado "número donador".
Galería de imágenes
Véase también
 En inglés: Solvation Facts for Kids
En inglés: Solvation Facts for Kids