Enlace (química) para niños
En química, un enlace químico es como una "unión" o "pegamento" que mantiene a los átomos y moléculas juntos. Gracias a estos enlaces, las sustancias que nos rodean, como el agua, el aire o los metales, son estables y tienen sus propiedades especiales. Imagina que los átomos son como piezas de un rompecabezas que se unen para formar algo más grande y fuerte.
La razón principal por la que los átomos se unen es para alcanzar una situación más estable. Piensa en ellos como si quisieran tener una "capa" completa de electrones en su parte más externa, similar a cómo se ven los gases nobles, que son muy estables. Los electrones tienen carga negativa y los protones en el núcleo tienen carga positiva. Cuando los electrones se colocan entre los núcleos de dos átomos, ayudan a que esos núcleos positivos se atraigan entre sí, formando el enlace.
Contenido
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman por la interacción de los electrones de los átomos. Hay diferentes maneras en que los átomos pueden compartir o transferir electrones para unirse.
Enlace Covalente: Compartiendo Electrones
En un enlace covalente, los átomos comparten uno o más pares de electrones. Es como si dos amigos compartieran un juguete para que ambos puedan jugar con él.
- Los electrones compartidos se sienten atraídos por los núcleos positivos de ambos átomos, lo que los mantiene unidos.
- Este tipo de enlace es muy común entre átomos no metálicos.
- Pueden ser:
- Simples: Comparten un par de electrones (ejemplo: H-H en la molécula de hidrógeno).
- Dobles: Comparten dos pares de electrones (ejemplo: O=O en la molécula de oxígeno).
- Triples: Comparten tres pares de electrones (ejemplo: N≡N en la molécula de nitrógeno).
- Cuantos más pares de electrones se compartan, más fuerte y corto será el enlace.
Enlace Covalente Polar y No Polar
- No polar: Se forma cuando los átomos que se unen son iguales o muy parecidos, por lo que los electrones se comparten de manera equitativa. La molécula no tiene un lado más positivo o negativo que otro (ejemplo: O-O).
- Polar: Se forma cuando los átomos son diferentes y uno atrae los electrones compartidos con más fuerza que el otro. Esto crea un lado ligeramente negativo y otro ligeramente positivo en la molécula, como un pequeño imán (ejemplo: H-O en el agua).
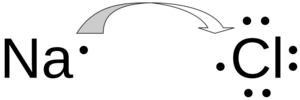
Enlace Iónico: Transfiriendo Electrones
En un enlace iónico, un átomo le "regala" uno o más electrones a otro átomo.
- Esto ocurre cuando hay una gran diferencia en la capacidad de los átomos para atraer electrones.
- El átomo que pierde electrones se vuelve positivo (se llama ion positivo o catión).
- El átomo que gana electrones se vuelve negativo (se llama ion negativo o anión).
- La atracción entre estas cargas opuestas es lo que forma el enlace.
- Es común entre un metal (que tiende a perder electrones) y un no metal (que tiende a ganarlos).
- Un ejemplo clásico es la sal de mesa, el cloruro de sodio (NaCl), donde el sodio (Na) le da un electrón al cloro (Cl).
Enlace Metálico: Un Mar de Electrones
En un enlace metálico, los átomos de metal comparten sus electrones de una manera muy especial.
- Los electrones de valencia (los más externos) no están fijos a un solo átomo, sino que se mueven libremente como un "mar" de electrones alrededor de los núcleos positivos de los metales.
- Esta libertad de movimiento explica por qué los metales son buenos conductores de electricidad y calor, y por qué son maleables (se pueden hacer láminas) y dúctiles (se pueden estirar en hilos).
- Los metales suelen ser sólidos a temperatura ambiente (excepto el mercurio) y tienen puntos de fusión altos.
Teorías sobre los enlaces químicos
A lo largo de la historia, los científicos han desarrollado diferentes teorías para entender cómo funcionan los enlaces químicos.
Primeras Ideas y la Regla del Octeto
Desde hace mucho tiempo, los científicos se preguntaban por qué los átomos se unían.
- En el siglo XVIII, Isaac Newton sugirió que los átomos se atraían por alguna "fuerza".
- A principios del siglo XX, químicos como Gilbert N. Lewis y Walther Kossel propusieron que los átomos se unen para completar su capa más externa con ocho electrones, una idea conocida como la regla del octeto. Esto les da la estabilidad de los gases nobles.
- Para el hidrógeno, la regla es diferente: busca tener dos electrones, lo que se conoce como la regla del dúo.
Teoría del Enlace de Valencia
Esta teoría, desarrollada por científicos como Linus Pauling, explica que los enlaces se forman cuando los electrones de valencia de dos átomos se unen y se comparten entre ellos. Es como si los orbitales (las zonas donde se encuentran los electrones) de los átomos se superpusieran.
Teoría de los Orbitales Moleculares
Esta teoría más avanzada dice que cuando los átomos se unen, sus orbitales atómicos se combinan para formar nuevos orbitales que pertenecen a toda la molécula, llamados orbitales moleculares. Estos orbitales pueden ser:
- Enlazantes: Los electrones en ellos mantienen los núcleos unidos.
- Antienlazantes: Los electrones en ellos debilitan el enlace.
- No enlazantes: Los electrones en ellos no afectan la fuerza del enlace.
Ambas teorías son importantes y se complementan para entender mejor los enlaces químicos.
Enlaces entre moléculas (Intermoleculares)
Además de los enlaces que mantienen unidos a los átomos dentro de una molécula (enlaces químicos), existen fuerzas que atraen o repelen a las moléculas entre sí. Estas se llaman fuerzas intermoleculares y son importantes para propiedades como el punto de fusión o ebullición de una sustancia.
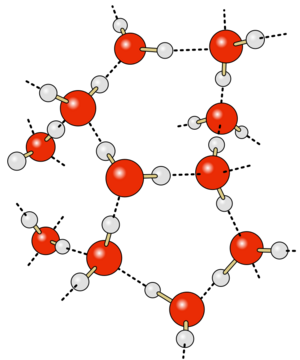
Enlace de Hidrógeno
Es una fuerza de atracción especial y fuerte que ocurre cuando un átomo de hidrógeno, que está unido a un átomo muy electronegativo (como oxígeno, nitrógeno o flúor), es atraído por otro átomo electronegativo de una molécula cercana.
- Es la razón por la que el agua tiene un punto de ebullición relativamente alto.
Fuerzas de Van der Waals
Son fuerzas más débiles que incluyen:
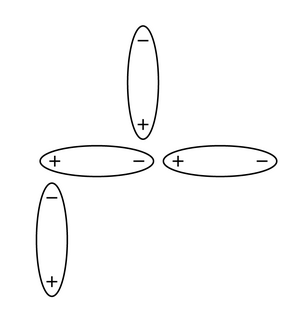
- Dipolo permanente a dipolo permanente: Ocurre entre moléculas que tienen un lado positivo y otro negativo de forma permanente.
- Dipolo instantáneo a dipolo inducido (Fuerzas de London): Son las más débiles y ocurren en todas las sustancias. Se deben a movimientos momentáneos de los electrones que crean pequeños desequilibrios de carga, atrayendo temporalmente a moléculas vecinas.
El Buckybalón: Una Molécula Sorprendente
En 1985, científicos como Harold Kroto, Robert F. Curl y Richard E. Smalley descubrieron una molécula de carbono muy especial llamada buckybalón (o buckminsterfulereno).
- Tiene la forma de una esfera hueca, como un balón de fútbol, con 60 átomos de carbono (C60).
- Cada átomo de carbono está en un vértice de esta esfera.
- Su descubrimiento fue tan importante que les valió el Premio Nobel de Química en 1996.
- Más tarde, se descubrieron estructuras similares en forma de tubos, llamadas nanotubos, que tienen muchas aplicaciones en la ciencia y la tecnología.
Galería de imágenes
-
Orbital molecular de tipo pi en la molécula de trifluoruro de boro.
Véase también
 En inglés: Chemical bond Facts for Kids
En inglés: Chemical bond Facts for Kids