Enlace π para niños
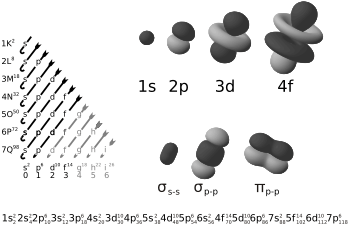
Los enlaces pi (también llamados enlaces π) son un tipo especial de unión química que ocurre entre átomos. Imagina que los electrones de un átomo no solo giran alrededor de su centro, sino que también ocupan ciertas "nubes" o "formas" llamadas orbitales. Cuando dos átomos se unen, sus orbitales pueden superponerse de diferentes maneras.
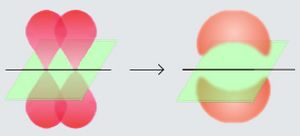
En un enlace pi, dos partes de un orbital de un átomo se unen con dos partes de un orbital de otro átomo. Piensa en ello como si dos nubes de electrones se tocaran por los lados, no de frente. Esto hace que los electrones de este enlace no estén justo en la línea que une los centros de los dos átomos.
La letra griega π se usa porque la forma de estos enlaces es muy parecida a la de los orbitales p, que son los que más a menudo forman este tipo de unión. A veces, otros tipos de orbitales, como los 'd', también pueden participar.
Contenido
¿Cómo se forman los enlaces pi?
Los enlaces pi se forman cuando los orbitales de dos átomos se superponen de forma lateral. Esto significa que las "nubes" de electrones se encuentran por encima y por debajo (o a los lados) de la línea imaginaria que une los núcleos de los átomos.
Enlaces pi y enlaces sigma: ¿Cuál es la diferencia?
Existen otros tipos de enlaces, como los enlaces sigma. Los enlaces sigma se forman cuando los orbitales se superponen de frente, como si dos nubes de electrones chocaran directamente.
Los enlaces pi suelen ser un poco más débiles que los enlaces sigma. Esto se debe a que los electrones en un enlace pi están un poco más lejos de los centros de los átomos (los núcleos), lo que los hace un poco menos fuertes.
La importancia de los enlaces pi en las uniones múltiples
Aunque un enlace pi por sí solo es más débil que un enlace sigma, los enlaces pi son muy importantes porque suelen aparecer junto con los enlaces sigma para formar uniones más fuertes.
Cuando los átomos se unen con un solo enlace, siempre es un enlace sigma. Pero si se unen con un enlace doble o un enlace triple, ¡ahí es donde entran los enlaces pi!
- Un enlace doble tiene un enlace sigma y un enlace pi.
- Un enlace triple tiene un enlace sigma y dos enlaces pi.
La combinación de enlaces sigma y pi hace que las uniones dobles y triples sean mucho más fuertes y cortas que un enlace simple. Por ejemplo:
- En el etano, que tiene un enlace simple entre carbonos, la distancia es de 154 picómetros (pm).
- En el etileno, con un enlace doble, la distancia es de 133 pm.
- En el acetileno, con un enlace triple, la distancia es de 120 pm.
Esto demuestra que cuantos más enlaces pi hay, más corta y fuerte es la unión entre los átomos.
¿Por qué no pueden girar los enlaces pi?
Una característica importante de los enlaces pi es que impiden que las partes de una molécula giren libremente alrededor del enlace. Imagina que los orbitales p que forman el enlace pi son como dos manos que se agarran por los lados. Si intentas girar una mano sin soltarla, el agarre se rompería. De la misma manera, para que una molécula gire alrededor de un enlace doble o triple, el enlace pi tendría que romperse, lo cual requiere mucha energía.
Casos especiales de enlaces pi
Aunque lo más común es que los enlaces pi aparezcan junto con un enlace sigma, existen algunos casos especiales donde dos átomos se unen solo con enlaces pi, sin ningún enlace sigma. Estos son casos menos comunes y se encuentran en algunas moléculas muy específicas.
Véase también
 En inglés: Pi bond Facts for Kids
En inglés: Pi bond Facts for Kids