Enlace σ para niños
En química, un enlace sigma (también escrito como enlace σ) es el tipo de unión más fuerte entre dos átomos. Es una forma de enlace covalente, lo que significa que los átomos comparten electrones para mantenerse unidos. Los enlaces sigma son incluso más fuertes que los enlaces pi, que también forman parte de las uniones químicas.
Imagina que los átomos tienen "nubes" o "espacios" donde se mueven sus electrones, llamados orbitales atómicos. Un enlace sigma se forma cuando estas "nubes" se unen de frente, como si dos personas se dieran la mano directamente. Esta unión es muy estable y fuerte.
El símbolo σ es la letra griega para la letra "s". Se usa porque la forma de un enlace sigma se parece a la forma de un orbital atómico s, que es como una esfera.
Contenido
¿Qué es un Enlace Sigma?
Un enlace sigma es una conexión química muy fuerte que se forma cuando los orbitales de dos átomos se superponen directamente, es decir, se unen "cara a cara". Esta superposición crea una zona de alta densidad de electrones entre los dos núcleos de los átomos, lo que los mantiene unidos.
Los electrones que participan en estos enlaces tan fuertes a veces se llaman "electrones sigma". Son los responsables de la estabilidad de muchas moléculas.
¿Cómo se forman los Enlaces Sigma?
Los enlaces sigma se forman por la superposición frontal de los orbitales atómicos. Esto significa que las "nubes" de electrones de dos átomos se encuentran y se fusionan directamente a lo largo de la línea que une los centros de los dos átomos.
En moléculas con solo dos átomos (llamadas diatómicas), un enlace sigma es simétrico. Esto quiere decir que si giraras la molécula alrededor de la línea que une los dos átomos, el enlace se vería igual.
Tipos de Enlaces Sigma
Los enlaces sigma pueden formarse de diferentes maneras, dependiendo de los tipos de orbitales atómicos que se unen:
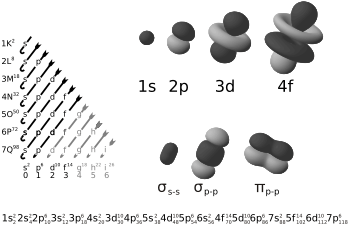
- Orbital s con orbital s: Cuando dos orbitales esféricos (tipo s) se unen de frente.
- Orbital p con orbital p: Cuando dos orbitales con forma de "pesa" (tipo p) se unen por sus extremos.
- Orbital s con orbital p: Cuando un orbital esférico (s) se une con el extremo de un orbital con forma de "pesa" (p).
- También pueden participar otros orbitales más complejos, como los de tipo d.
Cuando los orbitales se mezclan, las "nubes" de electrones se combinan para formar nuevos espacios donde los electrones pueden moverse, llamados orbitales moleculares. En un enlace sigma, no hay zonas vacías de electrones (llamadas planos nodales) entre los átomos que se unen. Sin embargo, en un enlace "anti-sigma" (σ*), sí existe una zona sin electrones entre los dos átomos.
Enlaces Sigma en Moléculas Grandes
Los enlaces sigma no solo existen en moléculas pequeñas de dos átomos, sino también en moléculas más grandes, que tienen muchos átomos (llamadas poliatómicas). En estas moléculas, los enlaces sigma también se forman por la unión frontal de los orbitales atómicos.
Ejemplos de Enlaces Sigma
Un buen ejemplo es el propano, una molécula que tiene tres átomos de carbono y ocho átomos de hidrógeno. En el propano, todos los enlaces entre los átomos de carbono (C-C) y entre el carbono y el hidrógeno (C-H) son enlaces sigma. Esto significa que el propano tiene diez enlaces sigma en total.
Aunque en moléculas grandes los enlaces sigma pueden estar un poco más "extendidos" o "deslocalizados" (no fijos en un solo punto), el concepto de enlace sigma sigue siendo muy útil para entender cómo se unen los átomos y cómo se forman las moléculas.
Véase también
 En inglés: Sigma bond Facts for Kids
En inglés: Sigma bond Facts for Kids
- Enlace pi
- Enlace delta
- Geometría molecular