Ecuación de Nernst para niños
La ecuación de Nernst es una fórmula muy útil en el mundo de la química y la electricidad. Se usa para calcular el potencial de reducción de un electrodo (una parte de un sistema eléctrico donde ocurren reacciones químicas) cuando las condiciones no son las "estándar". Las condiciones estándar son como un punto de partida fijo: una concentración de 1 M (molar), una presión de 1 atmósfera y una temperatura de 298 K (o 25 °C).
Esta ecuación lleva el nombre del científico alemán Walther Nernst, quien la creó en 1889. Gracias a ella, podemos entender mejor cómo funcionan las pilas y otras reacciones químicas que producen electricidad.
Contenido
¿Qué es la Ecuación de Nernst?
La ecuación de Nernst nos ayuda a saber cómo cambia el voltaje o "fuerza" de una reacción química cuando las condiciones no son las ideales. Imagina que tienes una pila; su voltaje puede variar un poco si la temperatura es diferente o si las sustancias químicas dentro de ella no tienen la concentración esperada. La ecuación de Nernst nos permite calcular ese cambio.
Las Partes de la Ecuación
La forma más común de la ecuación de Nernst, especialmente a una temperatura de 25 °C, es:
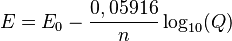
Vamos a ver qué significa cada parte:
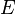 : Es el potencial real del electrodo o de la pila en las condiciones actuales. Es lo que queremos calcular.
: Es el potencial real del electrodo o de la pila en las condiciones actuales. Es lo que queremos calcular.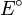 (o Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{0} ): Es el potencial estándar. Este valor es como el "ideal" y se encuentra en tablas para diferentes reacciones.
(o Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): E_{0} ): Es el potencial estándar. Este valor es como el "ideal" y se encuentra en tablas para diferentes reacciones.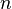 : Es la cantidad de moles de electrones que se mueven en la reacción química.
: Es la cantidad de moles de electrones que se mueven en la reacción química.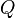 : Se llama el "cociente de reacción". Es un valor que nos dice cómo están las concentraciones de las sustancias que reaccionan y las que se forman en un momento dado.
: Se llama el "cociente de reacción". Es un valor que nos dice cómo están las concentraciones de las sustancias que reaccionan y las que se forman en un momento dado.
¿Qué es el Cociente de Reacción (Q)?
Para una reacción química general como: 
Donde A y B son las sustancias iniciales (reactivos) y C y D son las sustancias finales (productos), el cociente de reacción 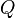 se calcula así:
se calcula así:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): Q = \frac{\mathrm{[C]}^c\mathrm{[D]}^d}{\mathrm{[A]}^a\mathrm{[B]}^b}
![\rm [C]](/images/math/0/e/2/0e2e63b47a1c926acbb714c32bbe4e14.png) ,
, ![\rm [D]](/images/math/2/6/0/26096714cef320e367f200f9dd27dfb8.png) ,
, ![\rm [A]](/images/math/2/d/4/2d4eaacbf44754cfbabfb046a4fb54b6.png) ,
, ![\rm [B]](/images/math/7/b/7/7b7d08b553112fb57fbb10979ed3c2b0.png) : Son las concentraciones de las sustancias.
: Son las concentraciones de las sustancias. ,
, 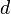 ,
, 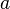 ,
, 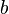 : Son los números que acompañan a cada sustancia en la ecuación química balanceada (llamados coeficientes estequiométricos).
: Son los números que acompañan a cada sustancia en la ecuación química balanceada (llamados coeficientes estequiométricos).
Es importante saber que las sustancias en estado sólido (como un metal) no se incluyen en el cálculo de 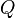 , porque su concentración se considera constante.
, porque su concentración se considera constante.
¿Cómo se Usa en las Pilas?
La ecuación de Nernst es muy importante para entender cómo funcionan las pilas (como las baterías que usas en tus aparatos). El voltaje total de una pila se calcula restando los potenciales de sus dos electrodos. La ecuación de Nernst nos permite ajustar esos potenciales según las condiciones reales de la pila.
La fórmula para el voltaje de una pila (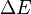 ) es:
) es:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Delta E = \Delta E^{0} - \frac{0,05916}{n}\log_{10}(Q)
Aquí, 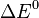 es el voltaje de la pila en condiciones estándar.
es el voltaje de la pila en condiciones estándar.
Un Ejemplo de Aplicación
Imagina una reacción en una pila donde el aluminio (Al) y el zinc (Zn) están involucrados:
<chem>2 Al (s) + 3 Zn^{2+} -> 2 {Al}^{3+} + 3 Zn (s)</chem>
En esta reacción, se mueven 6 moles de electrones, así que Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): n = 6 . El cociente de reacción 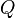 para esta pila sería:
para esta pila sería: ![Q = \rm \frac{[Al^{3+}]^2}{[Zn^{2+}]^3}](/images/math/3/c/0/3c0c0ab9608372fe2f1fa983a2cf16be.png)
Fíjate que el aluminio sólido (Al (s)) y el zinc sólido (Zn (s)) no aparecen en la fórmula de 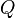 porque son sólidos.
porque son sólidos.
Unidades de Medida
El potencial de reducción y el voltaje de las pilas se miden en voltios (V). Las concentraciones en el cociente 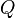 no tienen unidades, por lo que el resultado del logaritmo es un número sin unidades.
no tienen unidades, por lo que el resultado del logaritmo es un número sin unidades.
Galería de imágenes
Véase también
 En inglés: Nernst equation Facts for Kids
En inglés: Nernst equation Facts for Kids



