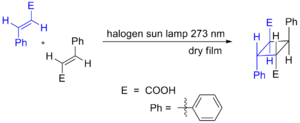Cicloadición para niños
Una cicloadición es un tipo especial de reacción química donde dos moléculas se unen para formar una nueva molécula con forma de anillo. En este proceso, algunos enlaces químicos llamados "enlaces pi" (π) se rompen y se forman nuevos enlaces llamados "enlaces sigma" (σ), que son más fuertes y estables.
Estas reacciones son muy importantes en la química porque permiten construir moléculas complejas de manera eficiente. Imagina que tienes dos piezas de LEGO y las unes para formar una figura cerrada; algo así ocurre en una cicloadición.
Las cicloadiciones se nombran según el número de átomos que participan en la formación del nuevo anillo. Por ejemplo, la famosa reacción de Diels-Alder es una cicloadición [4+2], lo que significa que una molécula aporta 4 átomos y la otra 2 átomos para formar el anillo. Otra es la cicloadición 1,3-dipolar, que es una cicloadición [3+2].
Contenido
¿Cómo ocurren las cicloadiciones?
Las cicloadiciones pueden ocurrir de diferentes maneras, dependiendo de la energía que las impulse.
Cicloadiciones por calor (Térmicas)
Algunas cicloadiciones ocurren cuando se les aplica calor. En estas reacciones, los electrones de las moléculas se mueven de una forma específica para que los enlaces se rompan y se formen los nuevos. Generalmente, estas reacciones térmicas siguen reglas de simetría que determinan cómo se unen las moléculas.
Un ejemplo de cicloadición térmica es la dimerización de la cetena, donde dos moléculas de cetena se unen para formar un anillo.
Cicloadiciones por luz (Fotoquímicas)
Otras cicloadiciones necesitan luz para activarse. Cuando la luz incide sobre una de las moléculas, le da energía a sus electrones, lo que los "excita" y los prepara para reaccionar. Esto permite que la reacción ocurra de una manera diferente a como lo haría con calor.
Un ejemplo es la dimerización fotoquímica del ácido cinámico. Cuando la luz activa dos moléculas de ácido cinámico, estas se unen para formar diferentes tipos de ácido truxílico.
Cicloadiciones con anillos especiales
Algunas cicloadiciones no solo involucran enlaces pi, sino también anillos que tienen mucha tensión, como el ciclopropano. Estos anillos son un poco inestables y pueden abrirse para participar en reacciones que se parecen a las cicloadiciones.
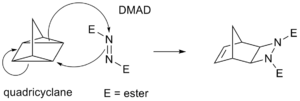
Un ejemplo es la reacción del cuadriciclano con otra molécula llamada DMAD. El cuadriciclano es una molécula con un anillo muy tenso que reacciona de forma similar a una cicloadición.
Nomenclatura de las cicloadiciones
Para nombrar las cicloadiciones, se usa una notación entre paréntesis (i+j+...). Los números i y j indican cuántos átomos de cada molécula inicial participan en la formación del nuevo anillo.
Por ejemplo:
- Una reacción de Diels-Alder es una cicloadición (4+2), porque una molécula aporta 4 átomos y la otra 2.
- Una adición dipolar 1,3, como el primer paso en la ozonólisis (un proceso para romper enlaces dobles), es una cicloadición (3+2).
Véase también
 En inglés: Cycloaddition Facts for Kids
En inglés: Cycloaddition Facts for Kids