Espectroscopía infrarroja para niños
La espectroscopia infrarroja es una técnica científica que nos permite estudiar cómo la luz infrarroja interactúa con diferentes materiales. Imagina que la luz infrarroja es como una lupa especial que nos ayuda a ver las "huellas dactilares" de las moléculas. Al observar cómo los materiales absorben, emiten o reflejan esta luz, los científicos pueden identificar qué sustancias químicas están presentes o cómo están organizadas.
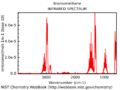
Esta técnica se usa para analizar sustancias en estado sólido, líquido o gaseoso. Para hacerlo, se utiliza un aparato llamado espectrómetro infrarrojo, que crea un espectro infrarrojo. Este espectro es como un gráfico que muestra cuánta luz infrarroja absorbe un material en diferentes "colores" (frecuencias o longitudes de onda) de la luz infrarroja. Las unidades que se usan para medir estas frecuencias son los centímetros recíprocos (cm-1) o los micrómetros (μm). Un tipo común de espectrómetro es el de transformada de Fourier (FTIR).
La luz infrarroja es parte del espectro electromagnético, que incluye desde las ondas de radio hasta los rayos X. La región infrarroja se divide en tres partes:
- Infrarrojo cercano: Tiene más energía y se usa para estudiar cómo las moléculas vibran de formas más complejas.
- Infrarrojo medio: Es la región más común para estudiar las vibraciones básicas de las moléculas y su estructura.
- Infrarrojo lejano: Tiene menos energía y se usa para vibraciones de baja frecuencia o para ver cómo las moléculas giran.
Contenido
¿Cómo funciona la espectroscopia infrarroja?
La espectroscopia infrarroja funciona porque cada molécula tiene una forma única de vibrar. Piensa en los átomos de una molécula como si estuvieran unidos por pequeños resortes. Cuando la luz infrarroja con la energía correcta choca con una molécula, hace que esos "resortes" vibren más fuerte. Cada tipo de enlace químico (como el que une el carbono con el oxígeno o el hidrógeno) vibra a una frecuencia específica.
Cuando una molécula absorbe luz infrarroja, significa que la frecuencia de esa luz coincide con la frecuencia natural de vibración de alguno de sus enlaces. Es como si la luz "resonara" con la molécula. Al medir qué frecuencias de luz infrarroja son absorbidas, los científicos pueden saber qué tipos de enlaces y grupos de átomos están presentes en una sustancia.
Modos de vibración molecular
Las moléculas pueden vibrar de muchas maneras diferentes. Cada una de estas formas se llama "modo vibratorio". El número de modos vibratorios que tiene una molécula depende de cuántos átomos la componen y de si su forma es lineal o no.
Para que una vibración sea detectada por la espectroscopia infrarroja, debe haber un cambio en la distribución de la carga eléctrica de la molécula durante esa vibración. Si la molécula es muy simple y simétrica, como el nitrógeno (N2), su vibración principal no se verá en el espectro infrarrojo. Pero si es asimétrica, como el monóxido de carbono (CO), sí se detectará. Las moléculas más grandes y complejas tienen muchos enlaces y, por lo tanto, muchos picos en su espectro infrarrojo.
Por ejemplo, un grupo de átomos como el CH2 (dos hidrógenos unidos a un carbono) puede vibrar de varias formas:
- Estiramiento: Los enlaces se alargan o acortan. Puede ser simétrico (ambos enlaces a la vez) o antisimétrico (uno se alarga mientras el otro se acorta).
- Flexión: Los enlaces cambian de ángulo. Hay varios tipos, como "tijera", "balanceo", "aleteo" y "torsión".
|
Simetría
Dirección |
Simétrico | Antisimétrico |
|---|---|---|
| Radial | 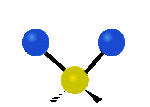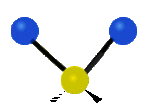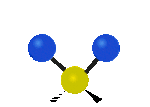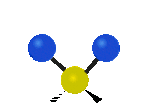 estiramiento simétrico |
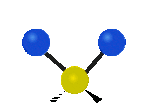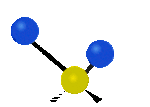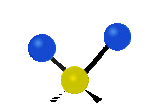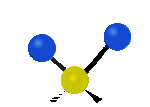 estiramiento antisimétrico |
| Latitudinal | 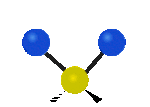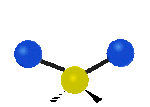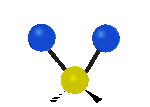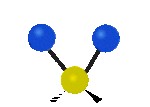 flexión de tijera |
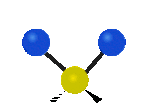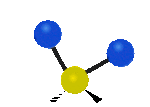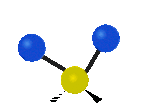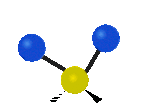 flexión de balanceo |
| Longitudal |  flexión de aleteo |
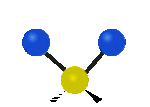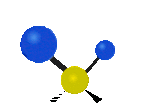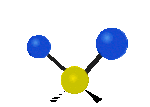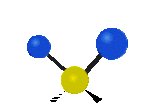 flexión de torsión |
¿Cómo se realiza la espectroscopia IR?
Para obtener un espectro infrarrojo, se hace pasar un haz de luz infrarroja a través de una muestra. Cuando la luz encuentra una vibración molecular que coincide con su frecuencia, parte de esa luz es absorbida. El espectrómetro mide cuánta luz se absorbió en cada frecuencia.
Esta técnica es muy útil para analizar muestras con enlaces covalentes (un tipo de unión entre átomos). Las muestras más puras y con menos enlaces activos en el infrarrojo dan espectros más sencillos. Las moléculas más complejas, en cambio, producen espectros con muchos picos.
Preparación de muestras
La forma de preparar una muestra depende de si es un gas, un líquido o un sólido:
- Muestras gaseosas: Se colocan en celdas especiales, a veces muy largas, para que la luz tenga suficiente espacio para interactuar con las moléculas del gas.
- Muestras líquidas: Se colocan entre dos placas hechas de una sal especial (como cloruro de sodio, la sal de mesa común) que es transparente a la luz infrarroja.
- Muestras sólidas: Se pueden moler finamente con un aceite mineral o con una sal purificada (como bromuro de potasio) y luego prensar la mezcla para formar una pastilla transparente. Otra forma es disolver la muestra en un líquido y dejar que se evapore para formar una película delgada. También se pueden cortar láminas muy finas de la muestra sólida.
Comparación con una referencia
Para obtener resultados precisos, es común comparar el espectro de la muestra con el de una "referencia". Esto ayuda a eliminar cualquier efecto del propio instrumento o del recipiente de la muestra. Por ejemplo, si se analiza una sustancia disuelta en agua, la referencia podría ser solo agua en el mismo recipiente. Así, el resultado final mostrará solo las propiedades de la sustancia que interesa.
Algunos espectrómetros modernos usan una técnica de "dos haces" para comparar la muestra y la referencia al mismo tiempo, lo que da resultados muy exactos.
Espectroscopia FTIR
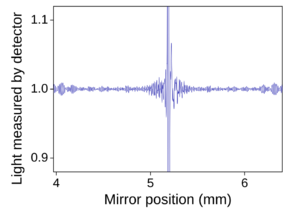
La espectroscopia de infrarrojos por transformada de Fourier (FTIR) es la técnica más usada hoy en día. En un equipo FTIR, la luz infrarroja pasa por un dispositivo llamado interferómetro antes de llegar a la muestra. Un espejo móvil dentro del interferómetro crea un patrón de luz llamado "interferograma". Luego, una operación matemática llamada "transformada de Fourier" convierte este interferograma en el espectro que los científicos pueden interpretar.
Los equipos FTIR son muy populares porque recogen información de todas las frecuencias de luz al mismo tiempo, lo que los hace rápidos y precisos.
Microscopía infrarroja
Existen también formas de microscopía infrarroja que combinan la espectroscopia IR con un microscopio. Esto permite analizar muestras muy pequeñas o ver cómo las sustancias están distribuidas en una superficie.
Otros métodos de estudio vibracional
La espectroscopia infrarroja no es la única forma de estudiar las vibraciones moleculares. La espectroscopia Raman es otra técnica importante que complementa a la IR, ya que detecta vibraciones que la IR no puede ver. También existe la espectroscopia de pérdida de energía de electrones (EELS), que usa electrones en lugar de luz para estudiar las vibraciones, especialmente en superficies.
Bandas de absorción y su significado
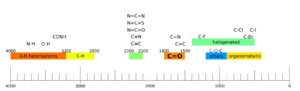
La espectroscopia IR se usa mucho para identificar la estructura de las moléculas porque ciertos grupos de átomos (llamados "grupos funcionales") producen "bandas" o picos característicos en el espectro. Estos picos aparecen en posiciones (frecuencias) específicas y con cierta intensidad. Los científicos usan tablas de correlación para saber qué grupo funcional corresponde a cada pico.
El espectro infrarrojo se suele dividir en dos regiones:
- Región del grupo funcional: Aquí se encuentran los picos que identifican los grupos de átomos principales de una molécula.
- Región de huellas dactilares: Esta parte del espectro es más compleja, con muchos picos que forman un patrón único para cada compuesto, como una huella dactilar.
Usos y aplicaciones de la espectroscopia IR
La espectroscopia infrarroja es una herramienta muy versátil y confiable que se usa en muchos campos de la ciencia y la industria:
- Química: Para identificar sustancias químicas en laboratorios de investigación y en la industria.
- Control de calidad: Para asegurar que los productos tienen la composición correcta.
- Monitoreo: Para medir la concentración de gases, como el dióxido de carbono en invernaderos.
- Ciencia forense: Ayuda en investigaciones para identificar materiales, como la degradación de plásticos o ciertas sustancias en el cuerpo.
- Arte: Para analizar pigmentos en pinturas y manuscritos antiguos.
- Polímeros: Para medir el grado de polimerización en la fabricación de plásticos.
- Semiconductores: Para estudiar materiales usados en microelectrónica, como el silicio.
- Industria alimentaria: Para medir la concentración de diferentes compuestos en alimentos.
- Detección de fugas de gas: Se usa en dispositivos portátiles para encontrar fugas de gases en tuberías de transporte de gas natural y petróleo.
- Astronomía: La NASA ha usado la espectroscopia IR para crear una base de datos de hidrocarburos aromáticos policíclicos (HAP) en el universo. Se cree que los HAP son importantes para la formación de la vida y están muy extendidos en el espacio, asociados con la formación de estrellas y planetas.
Los avances tecnológicos han hecho que los espectrómetros IR sean cada vez más pequeños y portátiles, incluso se están desarrollando chips espectroscópicos que podrían integrarse en teléfonos inteligentes.
Efectos de los isótopos
Los isótopos son átomos del mismo elemento que tienen diferente número de neutrones. Aunque son el mismo elemento, su masa ligeramente diferente puede afectar cómo vibran en una molécula. Esto se puede observar en la espectroscopia infrarroja.
Por ejemplo, si comparamos una molécula de oxígeno con isótopos más pesados, veremos que la frecuencia de vibración de sus enlaces cambia. Esto se debe a que la masa de los átomos influye en la "rigidez" de los "resortes" que los unen. Los científicos usan fórmulas matemáticas para calcular cómo la masa de los isótopos afecta estas frecuencias.
Espectroscopia IR bidimensional
La espectroscopia infrarroja bidimensional es una técnica más avanzada que combina varios espectros infrarrojos para obtener información más detallada. Es como añadir una tercera dimensión a un gráfico, lo que permite ver relaciones más complejas entre las vibraciones de una molécula.
Una versión de esta técnica, la espectroscopia infrarroja bidimensional no lineal, utiliza pulsos de láser muy cortos (de femtosegundos) para estudiar cómo las moléculas se mueven y cambian en escalas de tiempo extremadamente rápidas. Esto es útil para entender la dinámica molecular y cómo diferentes partes de una molécula interactúan entre sí.
Galería de imágenes
-
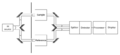
Esquema de un espectrómetro de absorción de dos haces. Se produce un haz de luz infrarroja, se pasa a través de un interferómetro (no se muestra) y luego se divide en dos haces separados. Uno pasa por la muestra, el otro pasa por una referencia. Los dos haces se reflejan hacia un detector, sin embargo, primero pasan a través de un divisor, que alterna rápidamente cuál de los dos haces entra en el detector. A continuación, se comparan las dos señales y se obtiene una impresión. Esta configuración de "dos haces" proporciona espectros precisos incluso si la intensidad de la fuente de luz varía con el tiempo.
-
Secuencia de pulsos utilizada para obtener un espectro infrarrojo de transformada de Fourier bidimensional. El período de tiempo
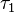 generalmente se conoce como el tiempo de coherencia y el segundo período de tiempo
generalmente se conoce como el tiempo de coherencia y el segundo período de tiempo 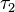 se conoce como el tiempo de espera. La frecuencia de excitación se obtiene mediante la transformación de Fourier a lo largo del eje
se conoce como el tiempo de espera. La frecuencia de excitación se obtiene mediante la transformación de Fourier a lo largo del eje 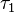 .
.
Véase también
 En inglés: Infrared spectroscopy Facts for Kids
En inglés: Infrared spectroscopy Facts for Kids
- Espectroscopia
- Espectroscopia de absorción
- Historia de la espectroscopia
- Reflectancia total atenuada (ATR)