Energía de Gibbs para niños
La energía de Gibbs es un concepto importante en la termodinámica, una rama de la física y la química que estudia cómo la energía se transforma y se usa. Esta energía nos ayuda a saber si un proceso o una reacción química puede ocurrir por sí misma (de forma espontánea) a una temperatura y presión constantes. También nos dice la cantidad máxima de trabajo útil que se puede obtener de un sistema.
La energía de Gibbs se representa con la letra G. Fue propuesta por el científico estadounidense Josiah Willard Gibbs en la década de 1870.
Plantilla:Ficha de concepto científico
Contenido
¿Qué es la Energía de Gibbs?
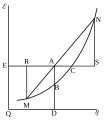
La energía de Gibbs es una "función de estado", lo que significa que su valor solo depende del estado inicial y final de un sistema, no del camino que se siga para llegar a ese estado. Se mide en unidades de energía, como los julios (J).
Imagina que tienes un sistema, como una pila que produce electricidad. La energía de Gibbs te dice cuánta de esa energía se puede usar para hacer un trabajo, como encender una bombilla, sin que se pierda en forma de calor o en cambios de volumen.
¿Quién fue Josiah Willard Gibbs?
Josiah Willard Gibbs (1839-1903) fue un físico y matemático estadounidense. Es considerado uno de los fundadores de la termodinámica moderna. En sus trabajos, especialmente en "Sobre el equilibrio de las sustancias heterogéneas" (1876), desarrolló muchas ideas clave, incluyendo la energía de Gibbs, que son fundamentales para entender cómo funcionan las reacciones químicas y los procesos físicos.
¿Para qué sirve la Energía de Gibbs?
La energía de Gibbs es muy útil para predecir si una reacción química ocurrirá de forma espontánea. Una reacción es espontánea si puede suceder por sí misma, sin necesidad de añadir energía extra de forma continua.
Según la segunda ley de la termodinámica, los sistemas tienden a buscar un estado de mínima energía. En el caso de la energía de Gibbs, si una reacción ocurre a temperatura y presión constantes, el sistema buscará alcanzar un valor mínimo de esta energía.
¿Cómo se relaciona con el trabajo útil?
La energía de Gibbs nos dice la cantidad máxima de trabajo que se puede obtener de una reacción química, sin contar el trabajo que se hace al cambiar el volumen (como cuando un gas se expande). Este trabajo útil puede ser, por ejemplo, la electricidad generada en una batería.
Si una reacción tiene un cambio negativo en la energía de Gibbs (ΔG negativo), significa que puede liberar energía útil. Si tiene un cambio positivo (ΔG positivo), necesitará que le demos energía para que ocurra.
¿Cómo se calcula la Energía de Gibbs?
La energía de Gibbs se calcula usando una fórmula que relaciona la entalpía (H), la entropía (S) y la temperatura (T) de un sistema.
La fórmula principal es: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): {\displaystyle G = H - TS}
Donde:
- G es la energía de Gibbs.
- H es la entalpía, que representa la energía total de un sistema.
- T es la temperatura, medida en Kelvin (K).
- S es la entropía, que mide el desorden o la aleatoriedad de un sistema.
Cambios en la Energía de Gibbs (ΔG)
Lo que más nos interesa en las reacciones químicas es el cambio en la energía de Gibbs, que se representa como ΔG (delta G). Este cambio nos dice si la energía de Gibbs disminuye o aumenta durante una reacción.
Para una reacción química como: 
El cambio de energía de Gibbs (ΔG) se calcula restando la energía de Gibbs de los productos menos la de los reactivos.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \Delta_{\rm r} G = (c\Delta_{\rm f} G_{\rm C} + d\Delta_{\rm f} G_{\rm D}) - (a\Delta_{\rm f} G_{\rm A} + b\Delta_{\rm f} G_{\rm B})\,\!
Donde:
- A y B son los reactivos.
- C y D son los productos.
- a, b, c, d son los números que equilibran la ecuación (coeficientes estequiométricos).
- ΔfG es la energía de Gibbs de formación de cada sustancia.
Es importante saber que la energía de Gibbs de formación para cualquier elemento en su forma más estable (por ejemplo, el oxígeno gaseoso O2 a 25 °C y 1 atmósfera) es cero.
La temperatura (T) es un factor muy importante en la fórmula. Puede hacer que una reacción sea espontánea o no, dependiendo de cómo afecte a la entropía.
¿Qué significan los valores de Delta G?
El valor de ΔG nos da información clave sobre una reacción:
| Valor de ΔG | Significado |
|---|---|
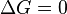 |
La reacción está en equilibrio. No hay un cambio neto, los productos se forman a la misma velocidad que los reactivos. |
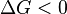 |
La reacción es espontánea. Puede ocurrir por sí misma y liberar energía útil. |
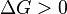 |
La reacción no es espontánea. No ocurrirá por sí misma. Necesita un aporte de energía para que suceda. |
Por ejemplo, la transformación de diamante a grafito tiene un ΔG negativo, lo que significa que es espontánea. Sin embargo, en la vida real, no vemos los diamantes convertirse en grafito rápidamente porque la reacción es extremadamente lenta. Esto nos enseña que la energía de Gibbs nos dice si una reacción es posible, pero no qué tan rápido ocurrirá.
Unidades de la Energía de Gibbs
Como la energía de Gibbs depende de la cantidad de materia, se suele expresar por cada cantidad de sustancia. En el Sistema Internacional de Unidades, se usa el julio por mol (J/mol). A veces también se usan kilocalorías por mol (kcal/mol).
Galería de imágenes
Véase también
 En inglés: Gibbs free energy Facts for Kids
En inglés: Gibbs free energy Facts for Kids