Tomografía por emisión de positrones para niños
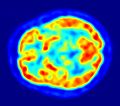
La tomografía por emisión de positrones (conocida como PET, por sus siglas en inglés) es una técnica especial de imagen médica que se usa en la medicina nuclear. Es como una cámara muy avanzada que ayuda a los médicos a ver cómo funcionan las partes de tu cuerpo por dentro.
A diferencia de otras técnicas como la tomografía computarizada (TC), que muestra la estructura de los órganos, la PET se enfoca en la función. Esto significa que puede mostrar dónde y cómo ocurren ciertos procesos químicos en el cuerpo, como el uso de energía por las células.
Para hacer una PET, se inyecta una pequeña cantidad de una sustancia especial llamada radiofármaco en el cuerpo. Este radiofármaco emite unas partículas muy pequeñas llamadas positrones. Cuando estas partículas chocan con otras partículas en el cuerpo, producen rayos gamma que son detectados por el escáner PET. Así, los médicos pueden ver qué áreas del cuerpo están más activas o tienen un metabolismo diferente.
El radiofármaco más usado es el fluorodesoxiglucosa (18FDG), que es similar al azúcar. Como las células que crecen rápidamente (como algunas células enfermas) usan mucho azúcar, el 18FDG ayuda a los médicos a identificarlas y localizarlas.
La PET es muy útil en varias áreas de la medicina, especialmente en el estudio de ciertas condiciones de salud, así como en neurología (para el cerebro) y cardiología (para el corazón). También se usa mucho en investigaciones médicas.
Contenido
¿Cómo se desarrolló la tecnología PET?
La idea de la tomografía por emisión de positrones comenzó a finales de la década de 1950. David E. Kuhl, Luke Chapman y Roy Edwards fueron pioneros en este concepto. Su trabajo llevó a la creación de los primeros instrumentos tomográficos en la Universidad de Pensilvania.
En 1975, otros científicos como Michel Ter-Pogossian, Michael E. Phelps y Edward J. Hoffman, en la Facultad de Medicina de la Universidad de Washington, desarrollaron más las técnicas de imagen. También, Gordon Brownell y Charles Burnham en el Hospital General de Massachusetts hicieron contribuciones importantes, incluyendo la primera demostración de cómo la radiación de aniquilación podía usarse para obtener imágenes médicas.
En 1961, James Robertson y su equipo en el Laboratorio Nacional Brookhaven construyeron el primer escáner PET de un solo plano. Un avance clave fue el desarrollo de los radiofármacos, especialmente el 2-fluorodeoxi-D-glucosa (2FDG), creado por Al Wolf y Joanna Fowler. Este compuesto se usó por primera vez en personas en agosto de 1976 en la Universidad de Pensilvania, lo que permitió obtener imágenes del cerebro.
A principios del siglo XXI, la PET se convirtió en una herramienta esencial para el diagnóstico médico. Su uso se ha extendido por todo el mundo, siendo muy común en Europa y Estados Unidos. Los equipos modernos de PET pueden realizar estudios de cuerpo entero en menos de 20 minutos y ofrecen imágenes muy detalladas.
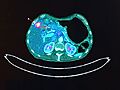
Hoy en día, muchos equipos de PET se combinan con escáneres de TC, creando equipos híbridos PET-CT. Esto es una gran ventaja porque permite a los médicos ver no solo la actividad metabólica (con PET) sino también la ubicación exacta de esa actividad en el cuerpo (con CT), lo que ayuda a identificar problemas más pequeños con mayor precisión.
¿Cómo funciona la PET?
La PET funciona detectando la radiación que emite una sustancia especial inyectada en el paciente. Esta sustancia contiene radioisótopos, que son átomos inestables que liberan energía al transformarse en una forma más estable. Este proceso se llama decaimiento radioactivo.
¿Qué es el decaimiento radioactivo?
El decaimiento radioactivo es cuando un átomo inestable libera partículas para volverse más estable. En el caso de la PET, se usan radiofármacos que emiten positrones. Es importante que estos radiofármacos tengan una "vida media" corta, lo que significa que su radioactividad disminuye rápidamente, para que el impacto en el cuerpo del paciente sea mínimo.
Los radioisótopos usados en PET emiten un tipo de radiación llamada beta positiva (β+).
Emisión de partículas β+
En la emisión β+, un protón dentro del núcleo del átomo se convierte en un neutrón, liberando un positrón (que es como un electrón con carga positiva) y otra partícula muy pequeña. Estos positrones son los que interesan para la técnica PET.
¿Cómo se forman las imágenes?
Cuando el radiofármaco se desintegra en el cuerpo, emite positrones. Estos positrones chocan con los electrones de los tejidos del cuerpo. Esta colisión se llama "aniquilación" y produce dos rayos gamma que viajan en direcciones opuestas.
Los escáneres PET están diseñados para detectar estos dos rayos gamma al mismo tiempo. Al detectar los rayos gamma que llegan "en coincidencia" (al mismo tiempo y en direcciones opuestas), el equipo puede determinar la línea exacta donde ocurrió la aniquilación. Esta línea se llama "línea de respuesta".
Al registrar muchas de estas líneas de respuesta desde diferentes ángulos, el equipo PET puede crear una imagen tridimensional de la distribución del radiofármaco en el cuerpo. Las áreas donde hay más radiofármaco aparecen más brillantes en la imagen, indicando mayor actividad metabólica.
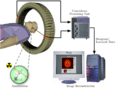
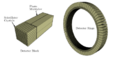
El escáner PET
La máquina de PET se parece mucho a la de una TC. Es un aparato grande con forma de anillo por donde pasa una camilla. El paciente se acuesta en la camilla y se mueve a través del anillo.
Antes de la prueba, se administra el radiofármaco al paciente, generalmente por una vena. El escáner PET tiene muchos detectores que forman anillos. Estos detectores están hechos de cristales especiales que transforman la energía de los rayos gamma en señales eléctricas, que luego se usan para crear la imagen.
Características de la PET
Velocidad de la prueba
Una prueba PET no es muy rápida; puede durar entre 30 minutos y 3 horas. Durante este tiempo, es importante que el paciente se mueva lo menos posible para que las imágenes sean claras.
Radiación
Los rayos gamma que se detectan en la PET son un tipo de radiación de alta energía. Aunque la cantidad de radiación es pequeña y se considera segura para el diagnóstico, los médicos siempre evalúan cuidadosamente si la prueba es necesaria.
Combinación con TC
Los escáneres PET a menudo se combinan con escáneres de TC (PET-CT). Esto es muy útil porque la TC ayuda a corregir cómo los tejidos del cuerpo absorben los rayos gamma, lo que mejora la precisión de las imágenes PET. Además, la TC proporciona una imagen estructural detallada que ayuda a los médicos a ubicar exactamente dónde se encuentra la actividad metabólica detectada por la PET.
Usos médicos de la PET
En el estudio de ciertas condiciones de salud
La PET es muy útil para estudiar ciertas condiciones de salud. Las células con crecimiento rápido, como algunas células enfermas, suelen usar mucha glucosa (azúcar). El radiofármaco 18FDG, que es similar a la glucosa, es captado por estas células, pero no puede ser procesado, quedando "atrapado" en ellas. Esto permite a los médicos ver dónde se encuentran estas células en el cuerpo.
La PET permite:
- Conocer la extensión de ciertas condiciones en el cuerpo.
- Evaluar cómo responde el cuerpo a un tratamiento, comparando estudios antes y después.
La prueba no es molesta ni dolorosa para el paciente. Es importante informar al médico si se está amamantando o si hay un bebé en desarrollo, ya que en estas situaciones se debe considerar posponer la prueba o tomar precauciones especiales. Antes de la prueba, se suele pedir al paciente que no coma ni haga ejercicio intenso.
Para el corazón (Cardiología)
En cardiología, la PET se usa para ver si el tejido del corazón que no está funcionando bien puede recuperarse. Esto es importante para decidir si un paciente se beneficiaría de un procedimiento para mejorar el flujo sanguíneo al corazón.
El corazón normalmente usa grasas como energía, pero si no recibe suficiente oxígeno, cambia a usar glucosa. La PET con 18F-FDG puede mostrar si el corazón está usando glucosa, lo que indica que el tejido aún está vivo y podría recuperarse.
Para el cerebro (Neurología)
La PET también se usa para estudiar enfermedades del cerebro, como la enfermedad de Alzheimer, otras demencias o el Parkinson. El cerebro usa mucha glucosa, por lo que la FDG es un radiofármaco ideal para estos estudios.
La PET puede mostrar cambios en el metabolismo de la glucosa en el cerebro, lo que ayuda a los médicos a identificar patrones asociados con estas enfermedades. También puede ayudar a determinar si un paciente con epilepsia podría beneficiarse de una cirugía. Para estudiar el flujo sanguíneo en el cerebro, se puede usar otro radiofármaco con oxígeno-15.
Preparación para la prueba PET
La prueba PET no es dolorosa. Es importante llevar ropa cómoda y sin objetos de metal.
Debes ayunar (no comer ni beber nada, excepto agua natural) al menos 4 horas antes de la prueba. Beber mucha agua ayuda a estar bien hidratado.
Si eres diabético, es muy importante que hables con el médico sobre cómo manejar tus niveles de azúcar e insulina antes de la prueba. Esto es crucial porque el radiofármaco FDG es similar a la glucosa, y los niveles de azúcar en sangre pueden afectar la calidad de las imágenes. El objetivo es que tus niveles de insulina sean bajos y el azúcar en sangre no esté demasiado alto. Antes de la prueba, se medirá tu nivel de glucosa, que debe ser inferior a 180.
Si estás amamantando o hay un bebé en desarrollo, debes informar al médico. En el caso de la lactancia, algunos radiofármacos pueden pasar a la leche materna, por lo que se recomienda evitar amamantar por unas horas después de la prueba. Puedes extraer leche antes de la prueba para tener suficiente para el bebé durante ese tiempo.
Antes de la prueba, el personal médico te preguntará sobre tu historial de salud, medicamentos que tomas, cirugías previas y otros tratamientos médicos recientes. Esta información es importante para interpretar correctamente los resultados de la PET.
A veces, se te pedirá que bebas un líquido de contraste o se te inyectará antes de la exploración. La duración total de la prueba puede variar.
Galería de imágenes
Véase también
 En inglés: Positron emission tomography Facts for Kids
En inglés: Positron emission tomography Facts for Kids
- Electromedicina
- Tecnología sanitaria
- SPECT
- Radiactividad
- Desintegración radiactiva
- Desintegración beta