Ley de Gay-Lussac para niños
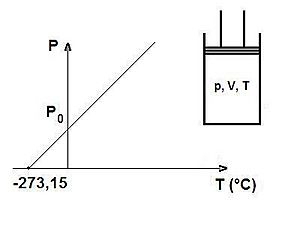
La ley de Gay-Lussac nos ayuda a entender cómo se comportan los gases. Esta ley dice que si tienes un gas en un recipiente cerrado que no cambia de tamaño (es decir, su volumen es fijo), la presión de ese gas aumenta si su temperatura sube. Y al revés, si la temperatura baja, la presión también disminuye. Esto significa que la presión y la temperatura son directamente proporcionales.
Contenido
¿Qué es la Ley de Gay-Lussac?
La Ley de Gay-Lussac es un principio científico que explica la relación entre la presión y la temperatura de un gas. Fue descubierta por el científico francés Louis Joseph Gay-Lussac. Imagina que tienes un globo muy resistente o un recipiente de metal sellado. Si calientas el aire dentro de ese recipiente, la presión del aire aumentará. Si lo enfrías, la presión bajará. Esto ocurre siempre y cuando el volumen del recipiente no cambie.
¿Cómo funciona esta ley?
Para entender por qué ocurre esto, piensa en las pequeñas partículas (moléculas) que forman el gas. Cuando calientas un gas, estas moléculas se mueven mucho más rápido. Al moverse más rápido, chocan con más fuerza y más a menudo contra las paredes del recipiente. Estos choques son lo que crea la presión. Como el recipiente no se hace más grande, las moléculas no tienen más espacio para moverse, así que los choques se vuelven más frecuentes y fuertes, aumentando la presión.
La ley se puede escribir con una fórmula sencilla: 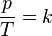 Aquí, "p" es la presión, "T" es la temperatura, y "k" es una constante. Esto significa que si divides la presión entre la temperatura, el resultado siempre será el mismo número, siempre que el volumen del gas no cambie.
Aquí, "p" es la presión, "T" es la temperatura, y "k" es una constante. Esto significa que si divides la presión entre la temperatura, el resultado siempre será el mismo número, siempre que el volumen del gas no cambie.
¿Qué pasa si la temperatura cambia?
Si tienes un gas en un estado inicial con una presión (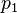 ) y una temperatura (
) y una temperatura (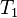 ), y luego cambias la temperatura a un nuevo valor (
), y luego cambias la temperatura a un nuevo valor (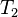 ), la presión también cambiará a un nuevo valor (
), la presión también cambiará a un nuevo valor (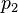 ). La relación entre ellos seguirá siendo la misma: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac{p_1}{T_1} = \frac{p_2}{T_2} Esto es muy útil para calcular cómo cambiará la presión de un gas si sabes cómo cambia su temperatura, o viceversa.
). La relación entre ellos seguirá siendo la misma: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac{p_1}{T_1} = \frac{p_2}{T_2} Esto es muy útil para calcular cómo cambiará la presión de un gas si sabes cómo cambia su temperatura, o viceversa.
La importancia de la temperatura absoluta
Es muy importante saber que, para usar la Ley de Gay-Lussac correctamente, la temperatura debe medirse en una escala especial llamada temperatura absoluta. Esta escala se conoce como Kelvin (K). No se usan grados Celsius (°C) ni Fahrenheit (°F) directamente. Si tienes la temperatura en Celsius, primero debes convertirla a Kelvin sumándole 273.15.
¿Cuándo es válida la Ley de Gay-Lussac?
La Ley de Gay-Lussac funciona muy bien para lo que llamamos "gases ideales". Un gas ideal es un modelo teórico que los científicos usan para simplificar cómo se comportan los gases. En la vida real, los gases son "gases reales". La ley de Gay-Lussac es muy precisa para los gases reales cuando la presión y la temperatura no son ni muy altas ni muy bajas, y cuando el gas no está muy apretado (tiene baja densidad).
Si la presión es muy alta, o si el gas está muy denso, la ley necesita algunos ajustes para ser más exacta. Por ejemplo, hay otras ecuaciones más complejas que se usan en esos casos para describir el comportamiento de los gases reales con mayor precisión.
Véase también
 En inglés: Ideal gas law Facts for Kids
En inglés: Ideal gas law Facts for Kids