Reacción electrocíclica para niños
Una reacción electrocíclica es un tipo especial de cambio químico donde una molécula se reorganiza. Imagina que tienes una cadena de átomos y, de repente, esa cadena se cierra para formar un anillo, o al revés, un anillo se abre para convertirse en una cadena. En estas reacciones, algunos enlaces químicos llamados "enlaces pi" (que son como uniones dobles o triples entre átomos) se transforman en "enlaces sigma" (que son uniones simples), o viceversa.
Estas reacciones son muy interesantes porque su resultado final, especialmente la forma tridimensional de la molécula, depende de cómo se mueven los electrones. Pueden ser provocadas por:
- Calor (reacciones térmicas) o por luz (reacciones fotoquímicas).
- El número de electrones especiales (electrones pi) que participan en la reacción.
- Si la reacción es un cierre de anillo (formando un ciclo) o una apertura de anillo (rompiendo un ciclo).
- La estereoespecificidad, que significa que la reacción produce un resultado muy específico en cuanto a la forma de la molécula. Esto se decide por cómo giran las partes de la molécula: de forma "conrotatoria" (ambas giran en la misma dirección) o "disrotatoria" (giran en direcciones opuestas). Estas formas de giro están predichas por unas reglas importantes llamadas Reglas de Woodward-Hoffmann.
La torcuoselectividad es una medida de qué tan selectiva es una reacción electrocíclica para seguir el modo conrotatorio o disrotatorio.
Un ejemplo conocido es la reacción de ciclización de Nazarov, que transforma ciertas moléculas llamadas divinilcetonas en ciclopentenonas (anillos de cinco lados).
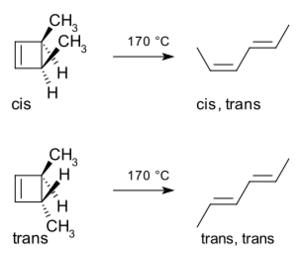
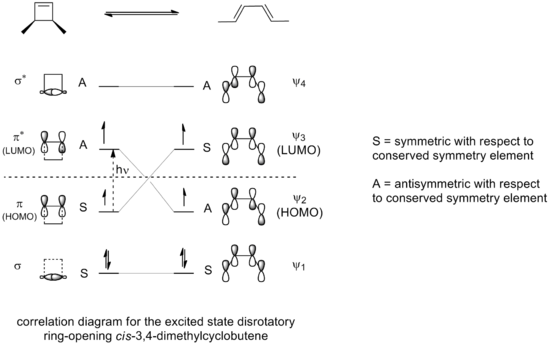
Un ejemplo clásico de apertura de anillo es el del 3,4-dimetilciclobuteno. Si tienes la forma cis de esta molécula (donde los grupos metilo están del mismo lado), al calentarla, se abre el anillo y se forma exclusivamente el cis,trans-2,4-hexadieno. Pero si tienes la forma trans (donde los grupos metilo están en lados opuestos), se forma el trans,trans-2,4-hexadieno.
La forma en que ocurre esta reacción se puede entender usando una idea sencilla: los enlaces que se rompen en el anillo se abren de tal manera que los nuevos enlaces que se forman tienen la simetría correcta para el producto final. Para el 3,4-dimetilciclobuteno, esto solo se logra con una apertura de anillo conrotatoria.
La siguiente tabla resume cómo la temperatura o la luz afectan el tipo de giro (conrotatorio o disrotatorio) según el número de electrones pi:
| Sistema (número de electrones pi) | Inducido por calor | Inducido por luz |
|---|---|---|
| "4n" electrones | Conrotatorio | Disrotatorio |
| "4n + 2" electrones | Disrotatorio | Conrotatorio |
Así, la forma específica en que se orientan las moléculas (estereoespecificidad) se decide por si la reacción sigue un proceso conrotatorio o disrotatorio.
Contenido
Reglas de Woodward-Hoffmann: ¿Cómo se predice el giro?
Las Reglas de Woodward-Hoffmann son un conjunto de principios que nos ayudan a predecir si una reacción electrocíclica ocurrirá de forma conrotatoria o disrotatoria. Estas reglas se basan en la simetría de los orbitales moleculares (las regiones donde se encuentran los electrones en una molécula).
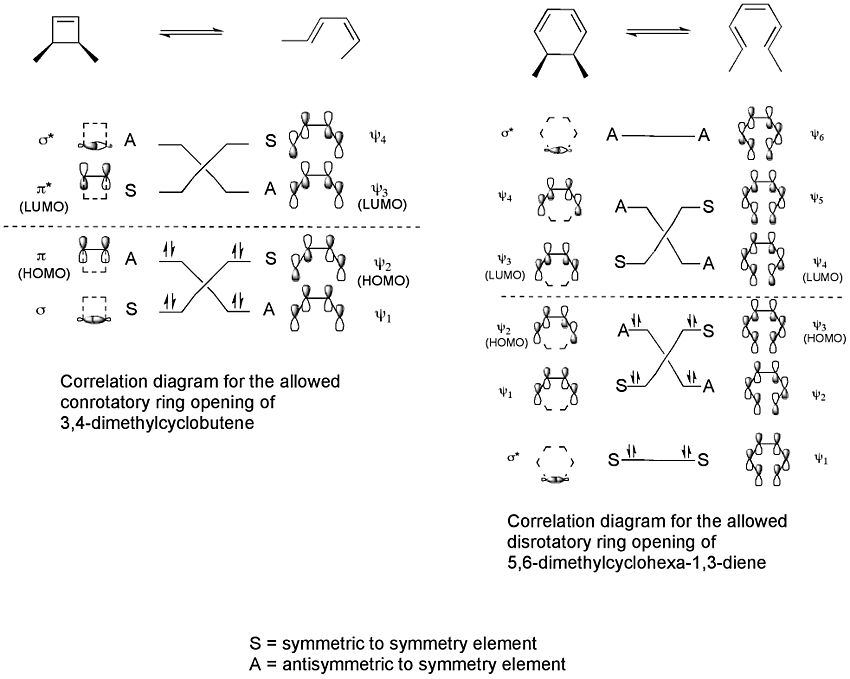
Podemos dibujar "diagramas de correlación" que muestran cómo los orbitales de la molécula inicial se conectan con los orbitales de la molécula final, manteniendo la misma simetría.
Estos diagramas nos dicen que, por ejemplo, para la apertura del anillo del 3,4-dimetilciclobuteno, solo el giro conrotatorio está permitido por la simetría. Esto es porque solo así los orbitales pueden unirse de la mejor manera posible durante la reacción, y el producto final se forma en su estado más estable.
Teoría de los Orbitales Frontera: Una mirada más cercana
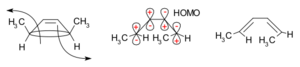
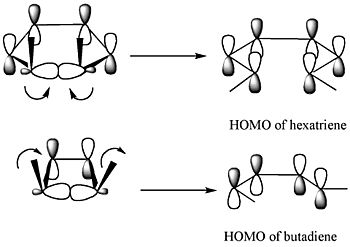
La Teoría de los orbitales moleculares frontera es otra forma de entender estas reacciones. Según esta teoría, cuando un enlace en un anillo se abre, los nuevos orbitales que se forman deben tener la misma simetría que el HOMO (el Orbital Molecular Ocupado más Alto) del producto. El HOMO es el orbital de mayor energía que contiene electrones.
Por ejemplo, para el 5,6-dimetilciclohexa-1,3-dieno, solo un giro disrotatorio permitiría que los orbitales tuvieran la simetría correcta para el producto. En cambio, para el 3,4-dimetilciclobuteno, solo un giro conrotatorio daría la simetría adecuada.
Reacciones electrocíclicas con luz
Si la apertura del anillo del 3,4-dimetilciclobuteno se hace usando luz (condiciones fotoquímicas), la reacción electrocíclica ocurrirá de forma disrotatoria, no conrotatoria. Esto se debe a que la luz "excita" los electrones a un nivel de energía más alto, cambiando las reglas de simetría.
En este caso, solo un giro disrotatorio, donde la simetría se mantiene a lo largo de la reacción, permite que los orbitales se unan de la mejor manera. Además, el producto que se forma también estará en un estado de energía más alto, similar al estado excitado de la molécula inicial.
Reacciones electrocíclicas en la naturaleza
Las reacciones electrocíclicas no solo ocurren en el laboratorio, ¡también son muy comunes en los seres vivos!
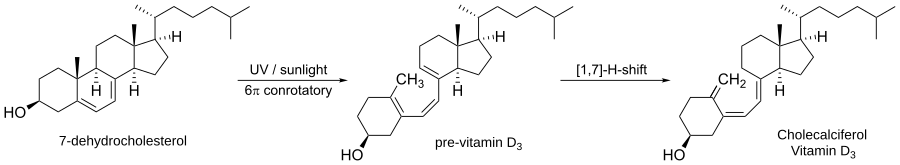
Un ejemplo importante es la forma en que nuestro cuerpo produce la vitamina D3.
El primer paso para formar la vitamina D3 en la piel es una apertura de anillo conrotatoria, provocada por la luz solar, de una molécula llamada 7-dehidrocolesterol. Esto forma la provitamina D3, que luego se transforma en vitamina D3.
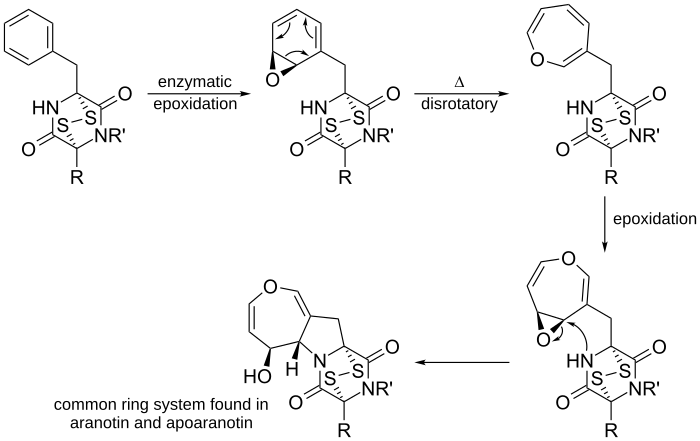
Otro ejemplo se encuentra en la formación de la aranotina, una molécula natural. En este proceso, una molécula se transforma enzimáticamente, y luego sufre una reacción electrocíclica de apertura de anillo disrotatoria que forma un anillo más grande. Después de otros pasos, se forma un sistema de anillos que es común en la aranotina y moléculas similares.
Véase también
 En inglés: Electrocyclic reaction Facts for Kids
En inglés: Electrocyclic reaction Facts for Kids