Proceso espontáneo para niños
Un proceso espontáneo es un cambio que ocurre en un sistema por sí mismo, sin necesidad de que algo externo lo impulse. Imagina que dejas caer una pelota; ella cae al suelo sin que tengas que empujarla. Eso es un proceso espontáneo. En la ciencia, estos procesos suelen liberar energía y buscan un estado más estable o "cómodo".
Cuando un proceso es espontáneo, significa que puede avanzar en una dirección específica sin ayuda de una fuente de energía externa. Por ejemplo, cuando el hielo se derrite en agua tibia, la sal se disuelve en agua o el hierro se oxida, todos son procesos espontáneos. Estos cambios ocurren porque la naturaleza tiende a buscar un mayor desorden o aleatoriedad, algo que los científicos llaman entropía.
Los principios de la termodinámica, que es la rama de la física que estudia la energía y el calor, nos ayudan a entender por qué ocurren estos procesos. Nos dicen que si hay muchas partículas interactuando (como átomos chocando), el proceso siempre irá en la dirección donde la entropía aumenta.
Contenido
¿Cómo sabemos si un proceso es espontáneo?
Para saber si un proceso es espontáneo, especialmente a una temperatura y presión constantes, los científicos usan un concepto llamado energía libre de Gibbs, que se representa con la letra griega delta y la G mayúscula (ΔG).
La fórmula para calcular la energía libre de Gibbs es: 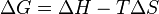
No te preocupes por la fórmula, lo importante es entender qué significa cada parte:
- ΔG es el cambio en la energía libre de Gibbs.
- ΔH es el cambio en la entalpía, que es la energía térmica (calor) que se libera o se absorbe.
- T es la temperatura, medida en Kelvin (una escala de temperatura).
- ΔS es el cambio en la entropía, que es el nivel de desorden o aleatoriedad.
El signo de ΔG nos dice si un proceso es espontáneo:
- Si ΔG es negativo, el proceso ocurre de forma espontánea en la dirección que estamos observando.
- Si ΔG es positivo, el proceso no es espontáneo en esa dirección, pero sí lo sería en la dirección opuesta.
- Si ΔG es cero, el sistema está en equilibrio, lo que significa que no hay un cambio neto ocurriendo.
Podemos ver cuatro situaciones principales al combinar los cambios de entalpía (ΔH) y entropía (ΔS):
- Si ΔS es positivo (más desorden) y ΔH es negativo (libera calor), el proceso siempre es espontáneo.
- Si ΔS es positivo y ΔH es positivo (absorbe calor), el proceso es espontáneo solo a temperaturas altas.
- Si ΔS es negativo (menos desorden) y ΔH es negativo, el proceso es espontáneo solo a temperaturas bajas.
- Si ΔS es negativo y ΔH es positivo, el proceso nunca es espontáneo.
¿Puede un proceso espontáneo disminuir el desorden?
Aunque la segunda ley de la termodinámica dice que la entropía total del universo siempre aumenta en un proceso espontáneo, a veces la entropía de un sistema específico puede disminuir. Esto no contradice la ley.
Imagina una reacción química que se vuelve más ordenada (su ΔS es negativo). Para que sea espontánea, debe liberar mucho calor (su ΔH debe ser muy negativo). Este calor liberado aumenta la temperatura de los alrededores, lo que a su vez aumenta la entropía de los alrededores de forma significativa. Así, aunque el sistema se ordene un poco, el desorden total (sistema más alrededores) sigue aumentando, y el proceso es espontáneo.
Espontaneidad y la velocidad de un proceso
Es importante saber que un proceso espontáneo no significa que ocurra rápidamente. Por ejemplo, los diamantes pueden transformarse en grafito de forma espontánea, pero este proceso es tan lento que tarda millones de años.
La velocidad a la que ocurre una reacción o un proceso depende de la cinética química, que es una rama de la química que estudia las velocidades de las reacciones. La espontaneidad solo nos dice si un proceso puede ocurrir por sí mismo, no qué tan rápido lo hará.
Cada sustancia en un proceso espontáneo tiende a transformarse en otra más estable. La estabilidad se logra cuando una sustancia tiene la menor energía posible o el mayor desorden posible. A veces, solo una de estas condiciones se aplica. Por ejemplo, el agua se convierte en hielo espontáneamente porque el hielo tiene menos energía y es más estable. Pero la formación de agua a partir de sus elementos también es espontánea porque las moléculas de agua están en un estado más desordenado.
Galería de imágenes
Véase también
 En inglés: Spontaneity (chemistry) Facts for Kids
En inglés: Spontaneity (chemistry) Facts for Kids

