Alótropos del carbono para niños
El carbono es un elemento muy especial que puede presentarse de diferentes maneras, llamadas alótropos. Imagina que el carbono es como un juego de piezas de construcción: con las mismas piezas (átomos de carbono), puedes armar estructuras muy distintas. Cada una de estas estructuras tiene propiedades y características físicas diferentes.
Contenido
- Diamante: La Gema Más Dura
- Grafito: El Secreto de los Lápices
- Grafeno: La Capa Más Fina
- Carbono Amorfo: Sin Forma Definida
- Fulerenos: Moléculas Huecas
- Carbono Vítreo: Como el Vidrio
- Nanoespuma de Carbono: Ligera como el Aire
- Lonsdaleíta: El Diamante Hexagonal
- Carbono Acetilénico Lineal (LAC)
- La Sorprendente Variabilidad del Carbono
- Otras Formas Posibles
- Véase también
Diamante: La Gema Más Dura
El diamante es uno de los alótropos de carbono más famosos. Es conocido por ser extremadamente duro y por cómo hace brillar la luz. Por eso, se usa tanto en joyería como en la industria. Es el mineral natural más duro que conocemos, ¡nada puede rayar un diamante excepto otro diamante!
Los diamantes se usan mucho en la industria para cortar, perforar y pulir materiales. Los diamantes que no son perfectos para joyas se usan para estas tareas. También existen los diamantes sintéticos, que se fabrican en laboratorios desde los años 1950. Cada año se producen muchísimos diamantes sintéticos para la industria, ¡cuatro veces más que los diamantes naturales!
Los diamantes industriales se valoran por su dureza y por cómo conducen el calor. Se usan en brocas para perforar, en sierras para cortar y en polvos para lijar y pulir. También tienen usos especiales en laboratorios para experimentos de alta presión y en algunas ventanas especiales.
Gracias a los avances en la fabricación de diamantes sintéticos, se están explorando nuevas aplicaciones. Por ejemplo, se investiga su uso como material para fabricar microchips en electrónica, o como disipadores de calor en dispositivos electrónicos.
Dentro de un diamante, cada átomo de carbono está unido a otros cuatro átomos de carbono, formando una estructura muy fuerte y estable. Esta red es la razón por la que el diamante es tan increíblemente duro.
Grafito: El Secreto de los Lápices
El grafito es otro alótropo muy común del carbono, y es el que usamos en los lápices para escribir. A diferencia del diamante, el grafito puede conducir la electricidad. Por eso, se usa en algunas baterías y en electrodos.
El grafito es la forma más estable de carbono en condiciones normales. Conduce la electricidad porque tiene electrones que pueden moverse libremente entre sus capas. En cambio, en el diamante, los electrones están fijos, por eso no conduce electricidad.
El grafito en polvo se usa como un lubricante seco, lo que significa que ayuda a que las cosas se deslicen sin necesidad de líquidos. Esto se debe a que entre sus capas hay aire y agua que permiten que se deslice fácilmente.
El grafito también es muy resistente al calor, aguantando temperaturas de hasta 3000 °C. Por eso, se utiliza en escudos térmicos para cohetes, en frenos y en motores eléctricos.
- Densidad: Es más ligero que el diamante.
- Efecto del calor: Es muy estable. A 2500 °C, puede transformarse en diamante. A unos 700 °C, arde en oxígeno puro, formando dióxido de carbono.
- Actividad química: Es un poco más reactivo que el diamante. Los líquidos y ácidos comunes no le afectan, pero algunos ácidos fuertes pueden oxidarlo.
Grafeno: La Capa Más Fina
El grafeno es una sustancia hecha de carbono puro, donde los átomos se organizan en un patrón hexagonal, como una red. Es como una sola capa de grafito, ¡increíblemente delgada! Fue teorizado hace mucho tiempo y aislado a temperatura ambiente.
Tiene propiedades eléctricas, térmicas y físicas extraordinarias. Se puede producir de varias maneras, y sus aplicaciones futuras podrían incluir reemplazar al silicio en dispositivos electrónicos de alto rendimiento.
Carbono Amorfo: Sin Forma Definida
El carbono amorfo es el nombre que se le da al carbono que no tiene una estructura cristalina definida. Es decir, sus átomos no están organizados en un patrón regular a largo plazo.
Aunque se puede fabricar carbono completamente amorfo, el carbono amorfo natural, como el hollín o el carbón, en realidad contiene pequeños cristales de grafito o incluso de diamante. A simple vista, el carbono amorfo no tiene una forma clara, pero si lo miras con un microscopio muy potente, verás que sus átomos de carbono están colocados de forma regular en pequeñas secciones.
El carbón y el hollín son ejemplos de lo que informalmente llamamos carbono amorfo. El carbón se clasifica según la cantidad de carbono que contiene. Por ejemplo, la antracita tiene alrededor del 90% de carbono, mientras que el lignito tiene cerca del 55%.
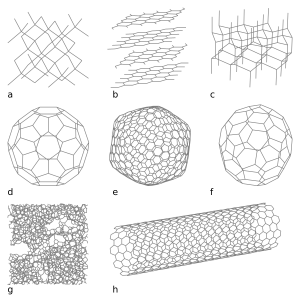
Fulerenos: Moléculas Huecas
Los fulerenos son moléculas de carbono que tienen forma de esfera hueca, elipsoide o tubo. Fueron descubiertos en 1985 por un equipo de científicos que incluso ganaron un Premio Nobel por ello. Recibieron su nombre por su parecido con las estructuras geodésicas diseñadas por el arquitecto Richard Buckminster Fuller.
Las propiedades de los fulerenos siguen siendo estudiadas. Se investiga su posible uso en medicina, por ejemplo, para unirse a ciertos medicamentos y ayudar a combatir bacterias o incluso algunas células de cáncer. También se han encontrado estas moléculas en el espacio, alrededor de estrellas distantes.
Buckybolas
Las buckybolas son un tipo de fulerenos esféricos, siendo la más conocida la C60, que tiene 60 átomos de carbono.
Nanotubos de Carbono
Los nanotubos de carbono, también llamados buckytubos, son moléculas de carbono con forma de cilindro. Son increíblemente pequeños, ¡unas 50,000 veces más delgados que un cabello humano!
Tienen propiedades extraordinarias de resistencia, son excelentes conductores de electricidad y de calor. Por eso, son muy útiles en campos como la nanoelectrónica y en la creación de nuevos materiales.
Nanobrotes de Carbono
Los nanobrotes de carbono son un tipo especial de carbono que combina fulerenos unidos a los lados de los nanotubos de carbono. Este material híbrido tiene propiedades muy interesantes, combinando lo mejor de ambos.
Schwarzites
Los schwarzites son moléculas de carbono con una forma curvada hacia adentro, como una silla de montar. Se crearon por primera vez dentro de los poros de unos minerales llamados zeolitas. Los científicos inyectan un vapor de carbono en la zeolita, y el carbono se adhiere a las paredes de los poros, formando esta estructura curvada. Luego, disuelven la zeolita para obtener el schwarzite.
Carbono Vítreo: Como el Vidrio
El carbono vítreo es un tipo de carbono que no se convierte en grafito fácilmente. Se usa mucho como material para electrodos en química, en recipientes que soportan altas temperaturas y en algunos dispositivos médicos.
Se fabrica calentando materiales orgánicos a temperaturas muy altas, hasta 3000 °C. A diferencia de otros carbonos, es impermeable a los gases y muy resistente a los químicos, especialmente si se prepara a temperaturas muy elevadas. Es tan resistente que no le afectan ácidos que sí disuelven el grafito normal.
Nanoespuma de Carbono: Ligera como el Aire
La nanoespuma de carbono es el quinto alótropo de carbono descubierto, en 1997. Está formada por pequeños grupos de átomos de carbono, unidos en una red tridimensional.
Cada grupo tiene unos 6 nanómetros de ancho y contiene alrededor de 4000 átomos de carbono, organizados en láminas parecidas al grafito, pero con una curvatura negativa. Esto es lo contrario de lo que ocurre en los fulerenos, donde las láminas de carbono tienen una curvatura positiva.
La nanoespuma de carbono es muy parecida a un aerogel, pero es aún más ligera, ¡solo unas pocas veces más densa que el aire! A diferencia de los aerogeles de carbono, la nanoespuma de carbono no es un buen conductor eléctrico.
Lonsdaleíta: El Diamante Hexagonal
La lonsdaleíta es un tipo de diamante con una estructura hexagonal. Se cree que se forma cuando los meteoritos que contienen grafito chocan contra la Tierra. El calor y la presión del impacto transforman el grafito en diamante, pero manteniendo su estructura hexagonal. También se ha logrado crear lonsdaleíta en laboratorios, calentando y comprimiendo grafito.
Carbono Acetilénico Lineal (LAC)
El carbono acetilénico lineal, también llamado carbino, es un alótropo de carbono que tiene una estructura química en forma de cadena repetitiva.
La Sorprendente Variabilidad del Carbono
El carbono puede presentarse en una variedad asombrosa de formas, cada una con propiedades muy diferentes, a pesar de estar hechas del mismo elemento.
Entre el diamante y el grafito, por ejemplo:
- El diamante tiene una estructura cúbica, mientras que el grafito tiene una estructura hexagonal.
- El diamante es el mineral natural más duro, pero el grafito es uno de los más blandos.
- El diamante es un abrasivo (para lijar), mientras que el grafito es un lubricante.
- El diamante es un aislante eléctrico, mientras que el grafito conduce la electricidad.
- El diamante es un excelente conductor de calor, mientras que algunas formas de grafito se usan para aislar del calor.
Otras Formas Posibles
- La caoíta es un mineral que podría formarse en impactos de meteoritos. Se dice que es un poco más duro que el grafito.
- El carbono metálico: Algunos estudios sugieren que el carbono, bajo presiones enormes, podría comportarse como un metal y ser superconductor a temperaturas muy bajas.
- A presiones extremadamente altas, se ha predicho que el diamante podría transformarse en una estructura cúbica especial.
- La hexagonita: Es una forma teórica donde se inserta un átomo especial entre los átomos de grafito.
- El Prismano C8 es otra forma que podría existir.
Véase también
 En inglés: Allotropes of carbon Facts for Kids
En inglés: Allotropes of carbon Facts for Kids