Voltamperometría para niños
La voltamperometría es un conjunto de técnicas especiales que los científicos usan para estudiar cómo se comportan las sustancias químicas cuando se les aplica electricidad. Imagina que tienes una pila y quieres saber cómo reacciona un material si le das más o menos energía eléctrica. Eso es lo que hace la voltamperometría.
En estas técnicas, se mide la cantidad de electricidad (llamada corriente) que pasa a través de una sustancia, mientras se cambia la cantidad de energía eléctrica (llamada potencial) que se le aplica. Esto se hace en un recipiente especial con electrodos, que son como pequeños cables que tocan la sustancia. Los electrodos que se usan en voltamperometría son muy pequeños, a veces de solo unos pocos milímetros, para que las mediciones sean muy precisas.
Los químicos usan la voltamperometría para entender cómo las sustancias se oxidan (pierden electrones) o se reducen (ganan electrones), cómo se pegan a las superficies y cómo se mueven los electrones en diferentes materiales. Es una herramienta muy útil en la química.
Contenido
Historia de la Voltamperometría
¿Cómo empezó la voltamperometría?
El inicio de la voltamperometría se dio gracias a un descubrimiento importante en 1922. Un científico llamado Jaroslav Heyrovský, quien ganó un Premio Nobel de Química, inventó una técnica llamada polarografía. Esta fue la primera forma de voltamperometría.
Al principio, las técnicas de voltamperometría tenían algunos desafíos que hacían difícil usarlas todos los días en los laboratorios. Pero con el tiempo, las cosas mejoraron mucho.
Avances importantes en la técnica
En 1942, otro científico, Hickling, construyó el primer aparato llamado potenciostato, que es clave para controlar la electricidad en estos experimentos.
Entre los años 1960 y 1970, hubo muchos avances. Se entendió mejor cómo funcionaba la técnica, se crearon instrumentos más avanzados y se empezaron a usar computadoras para controlar los experimentos. Esto hizo que las mediciones fueran mucho más exactas y se pudieran descubrir nuevos métodos de análisis. Gracias a estos avances, se empezaron a fabricar potenciostatos y electrodos más económicos y fáciles de usar en los laboratorios.
¿Cómo funciona la Voltamperometría?
La teoría detrás de las mediciones
Para entender los resultados de la voltamperometría, los científicos deben considerar no solo cómo las sustancias reaccionan (termodinámica), sino también la velocidad de esas reacciones (cinética). Esto es porque en la voltamperometría, el tiempo es un factor muy importante.
Aunque existen ecuaciones que describen las reacciones químicas sin considerar el tiempo, como la ecuación de Nernst, estas no son suficientes para explicar todo lo que sucede en la voltamperometría. Por eso, se usan otras ecuaciones más complejas que combinan la teoría con lo que se observa en los experimentos.
El sistema de tres electrodos
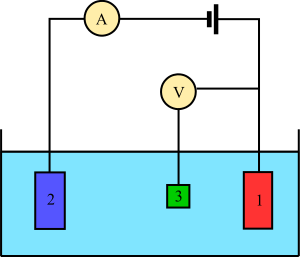
En los experimentos de voltamperometría, se estudia cómo reacciona una sustancia en una parte de una celda electroquímica. Generalmente, se controla el potencial (la "fuerza" eléctrica, medida en Voltios) de un electrodo que está en contacto con la sustancia, y al mismo tiempo se mide la corriente (la cantidad de electricidad, medida en Amperios) que se produce.
Para hacer un experimento, se necesitan al menos dos electrodos. El electrodo de trabajo es el que toca la sustancia y aplica el potencial deseado, permitiendo que los electrones se muevan hacia o desde la sustancia. El segundo electrodo actúa como la otra parte de la celda. Este segundo electrodo debería tener un potencial conocido para poder medir el potencial del electrodo de trabajo, y también debe equilibrar los electrones que se mueven en el electrodo de trabajo. Sin embargo, es muy difícil que un solo electrodo mantenga un potencial constante mientras maneja toda la corriente.
Para resolver este problema, se usan tres electrodos:
- El electrodo de referencia es como un punto de comparación. Tiene un potencial conocido y su única función es ayudar a medir y controlar el potencial del electrodo de trabajo. Por él no pasa corriente.
- El electrodo auxiliar es el que se encarga de pasar toda la corriente necesaria para equilibrar la corriente que se observa en el electrodo de trabajo.
- El electrodo de trabajo es el que ya mencionamos, donde ocurre la reacción principal con la sustancia que se está estudiando.
Estos tres electrodos (trabajo, referencia y auxiliar) forman el sistema moderno que se usa en la mayoría de los experimentos de voltamperometría.
A veces, se usan sistemas con más electrodos, pero la idea principal es la misma. Por ejemplo, el electrodo de disco-anillo rotatorio tiene dos electrodos de trabajo diferentes que pueden controlarse por separado.
En la práctica, es importante que el electrodo de trabajo esté muy limpio y tenga una superficie y tamaño conocidos. El electrodo auxiliar puede ser casi cualquier material que conduzca bien la electricidad y no reaccione con la sustancia. El electrodo de referencia es el más complejo y hay varios tipos estándar.
Además, en la mayoría de los experimentos de voltamperometría, se añade una sustancia inerte (llamada electrolito de soporte) a la solución. Esto ayuda a que la electricidad fluya mejor y mejora la precisión de los resultados.
Tipos de Voltamperometría
Existen muchos tipos de voltamperometría, cada uno diseñado para un propósito específico:
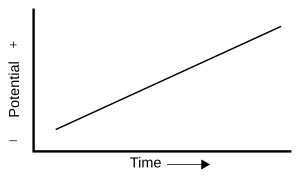
- Voltamperometría de barrido lineal: El potencial del electrodo de trabajo cambia de forma constante con el tiempo, y se mide la corriente.
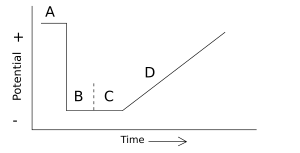
- Voltamperometría escalonada: El voltaje se aplica en pasos, se mide la corriente y se repite el proceso.
- Voltamperometría de onda cuadrada: Combina aspectos de otras técnicas de pulso para analizar la forma de onda.
- Voltamperometría cíclica: Se usa para saber qué tan rápido se mueven las sustancias y sus potenciales de reacción.
- Voltamperometría de redisolución anódica: Se usa para detectar pequeñas cantidades de metales. Primero se deposita el metal en el electrodo y luego se oxida para medir la corriente.
- Voltamperometría de redisolución catódica: Similar a la anódica, pero para detectar aniones (iones con carga negativa).
- Voltamperometría de redisolución por adsorción: La sustancia se pega al electrodo y luego se mide la corriente al hacerla reaccionar.
- Polarografía: Es un tipo especial de voltamperometría que usa un electrodo de gota de mercurio, muy útil por su superficie que se renueva constantemente.
- Voltamperometría de electrodo rotatorio: El electrodo de trabajo gira a gran velocidad. Es útil para estudiar la velocidad de las reacciones químicas.
- Voltamperometría de pulso diferencial: Se toman dos mediciones de corriente en cada paso, una antes y otra después de un pulso de voltaje.
Aplicaciones de la Voltamperometría
Sensores voltamperométricos
La voltamperometría se usa para crear sensores que pueden detectar sustancias específicas en la industria y en la investigación. Estos dispositivos, a veces llamados electrodos, son en realidad celdas voltamperométricas completas y se conocen como sensores.
Electrodo de oxígeno
Una aplicación muy importante es la medición de oxígeno disuelto en diferentes tipos de agua, como el agua de mar, la sangre, las aguas residuales y los suelos. Esto es fundamental para la industria, la investigación ambiental y médica. Uno de los métodos más comunes para esto es el sensor de Clark, inventado por L.C. Clark, Jr. en 1956.
Véase también
 En inglés: Voltammetry Facts for Kids
En inglés: Voltammetry Facts for Kids
- Método electroanalítico
- Voltamperometría cíclica
- Electrodo de trabajo
- Electrodo de referencia
- Electrodo auxiliar
Galería de imágenes
Enlaces externos
-
Esta obra contiene una traducción derivada de «Voltammetry» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 3.0 Unported.
- http://www.drhuang.com/science/chemistry/electrochemistry/polar.doc.htm
- https://web.archive.org/web/20091229082916/http://www.autolab-instruments.com/download/content/Appl021.pdf
- https://web.archive.org/web/20080509093044/http://www.amelchem.com/download/items/voltammetry/manuals/eng/manual_eng.pdf
- https://web.archive.org/web/20061020175748/http://new.ametek.com/content-manager/files/PAR/App%20Note%20E-4%20-%20Electrochemical%20Analysis%20Techniques1.pdf
- https://web.archive.org/web/20061221122151/http://www.prenhall.com/settle/chapters/ch37.pdf
cs:Polarografie ru:Полярография